
将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/LNaOH溶液中,生Na2CO3和NaHCO3的物质的量之比为
A.3:2 B.2:3 C.2:1 D.1:3
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素原子最外层电子排布呈周期性变化
C.元素的相对原子质量依次递增
D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
A. 单位时间内生成2a mol B,同时生成a molD
B. C的质量不再改变
C. 容器内的压强不随时间而变化
D. 混合气体的密度不再随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 _________ ;它含有的化学键类型有 _________
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
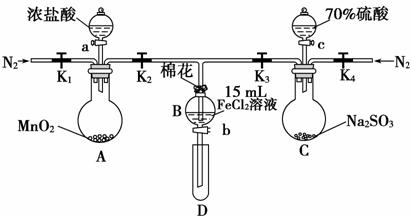
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________________________________________________。
(2)棉花中浸润的溶液为_________________________________________________。
(3)A中发生反应的化学方程式___________________________________________。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为________________________________________________________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“甲”、“乙”或“丙”)。
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中 | |
| 甲 | 有Fe3+无Fe2+ | 有SO |
| 乙 | 既有Fe3+又有Fe2+ | 有SO |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
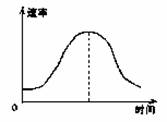
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由右图表 示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度; ④Cl-的浓度。影响反应速率的因素是 ( )
A. ①④ B.③④ C.①②③ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com