
��12�֣�ij�о�С�齫V1 mL 1.0 mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50 mL)���ش��������⣺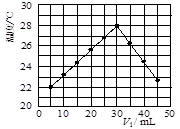
��1���о�С������ʵ��ʱ�����¶� (����ڡ���
�����ڡ����ڡ�)22 �棬�жϵ������� ��
(2)����ɼ�ͼ�ο�֪��V1�UV2= ʱ�����ǡ����ȫ�кͣ��˷�Ӧ����NaOH��Һ��Ũ��ӦΪ mol/L��
��3��ʵ��ʱ������ڼ������ȼ��л�ϣ����� ���裬ʹ��Һ��Ͼ��ȡ����йؼ���֪�˷�Ӧ���ų�Q kJ����������д���˷�Ӧ���Ȼ�ѧ����ʽ�� ��
 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
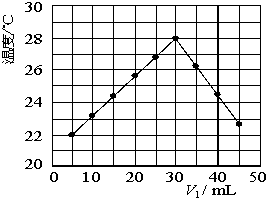 ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺
ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺| 3 |
| 2 |
| 3 |
| 2 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺
ij�о�С�齫V1 mL 1.0mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ������ͼ��ʾ��ʵ����ʼ�ձ���V1+V2=50mL�����ش��������⣺| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
| 100Q |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��12�֣�ij�о�С�齫V1 mL 1.0 mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50 mL)���ش��������⣺
��1���о�С������ʵ��ʱ�����¶� (����ڡ���
�����ڡ����ڡ�)22 �棬�жϵ������� ��
(2)����ɼ�ͼ�ο�֪��V1�UV2= ʱ�����ǡ����ȫ�кͣ��˷�Ӧ����NaOH��Һ��Ũ��ӦΪ mol/L��
��3��ʵ��ʱ������ڼ������ȼ��л�ϣ����� ���裬ʹ��Һ��Ͼ��ȡ����йؼ���֪�˷�Ӧ���ų�Q kJ����������д���˷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��ӱ�ʡ������ѧ�ڵ����ο��ԣ����ۣ���ѧ���� ���ͣ�ʵ����
��12�֣�ij�о�С�齫V1 mL 1.0 mol/L HCl��Һ��V2 mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1��V2��50 mL)���ش��������⣺
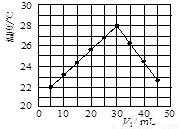
��1���о�С������ʵ��ʱ�����¶� (����ڡ���
�����ڡ����ڡ�)22 �棬�жϵ������� ��
(2)����ɼ�ͼ�ο�֪��V1�UV2= ʱ�����ǡ����ȫ�кͣ��˷�Ӧ����NaOH��Һ��Ũ��ӦΪ mol/L��
��3��ʵ��ʱ������ڼ������ȼ��л�ϣ����� ���裬ʹ��Һ��Ͼ��ȡ����йؼ���֪�˷�Ӧ���ų�Q kJ����������д���˷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com