
分析 (1)根据元素化合价的变化来判断氧化剂的化合价降低;根据反应方程式分析判断;
(2)在催化剂条件下NO和CO反应,生成CO2和N2.
解答 解:(1)二氧化氮中氮由+4价变成0价,所以二氧化氮是氧化剂,据反应CH4+2NO2=N2+CO2+2H2O可知1mol的甲烷消耗2mol的二氧化氮,所以当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理1molNO2,
故答案为:NO2;1;
(2)在催化剂条件下NO和CO反应,生成CO2和N2,反应的方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
点评 本题考查学生氧化还原反应中的概念以及化合价升降和电子转移知识,难度中等,注意知识的归纳和梳理是关键.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
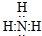 ,氯化铵
,氯化铵 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | CH4 (g)+2 O2(g)═CO2(g)+2 H2O (l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2 O2(g)═CO2(g)+2 H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | CH4(g)+2 O2 (g)═CO2(g)+2 H2O (l)△H=+890.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的简单离子是其所在周期中元素的简单离子半径最小的 | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Y与W形成的化合物一定能使酸性高锰酸钾溶液腿色 | |
| D. | 最高价氧化物对应水化物的酸性X比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO42- | |
| B. | 某无色溶液中滴入紫色石蕊试液显红色,该溶液可能有 CO 32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有 Ba2+ | |
| D. | 验证烧碱溶液中是否含有 Cl-,先加稍过量的稀硝酸除去 OH-,再加入 AgNO3溶液,如有 白色沉淀,则证明有 Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)=1×10-12mol•L-1的溶液中:A13+、Fe3+、SO42-、Cl- | |
| B. | pH=0的溶液中:Fe2+、Ba2+、NO3-、Cl- | |
| C. | 常温下,水电离的c(H+)为1×10-12mol•L-1的溶液中:Na+、NH4+、HCO3-、NO3- | |
| D. | 能使酚酞试液变红色的溶液中:Na+、K+、SiO32-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Al | C. | 稳定性:HF>CH4 | D. | 酸性:HClO<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
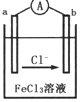 某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )| A. | Zn为负极,发生还原反应 | |
| B. | b电极反应式为ZFe3++2e-═2Fe2+ | |
| C. | 电子流动方向是a电极→FeCl3溶液→b电极 | |
| D. | 电池的正极材料可以选用石墨、铂电极,也可以用铜电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com