
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
分析 ①一元强酸和一元强碱等浓度、等体积混合后,溶液pH=7;
②等浓度的一元强酸和一元强碱混合,如碱体积大,碱过量,溶液呈碱性;
③一元弱酸和一元弱碱等浓度、等体积混合后,溶液不定;
④等浓度、等体积的一元弱酸和一元强碱混合,反应后溶液呈碱性.
解答 解:①一元强酸和一元强碱等浓度、等体积混合后,n(H+)=n(OH-),完全反应后,溶液pH=7,故①错误;
②等浓度的一元强酸和一元强碱混合,如碱体积大,碱过量,n(H+)<n(OH-),溶液呈碱性,pH>7,故②正确;
③一元弱酸和一元弱碱等浓度混合后,生成弱酸弱碱盐,pH大于7,说明溶液呈碱性,但溶液体积不一定为V(HX)=V(YOH),也可能为V(HX)<V(YOH),故③错误;
④等浓度、等体积的一元弱酸和一元强碱混合,反应后强碱弱酸盐,溶液水解成碱性,pH>7,故④正确.
故选D.
点评 本题考查酸碱混合的计算和判断,题目难度不大,注意强弱电解质的判断以及反应后对应盐溶液的水解.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 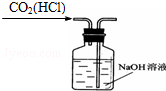 除去CO2中的HCl | B. | 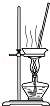 蒸发氯化钠溶液 | ||
| C. | 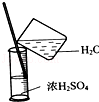 稀释浓硫酸 | D. | 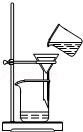 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
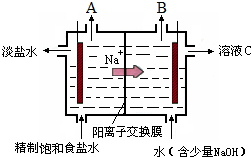 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
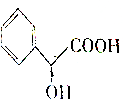 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
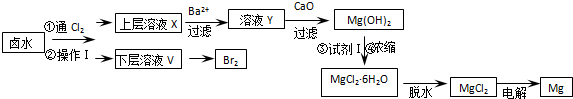
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com