
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
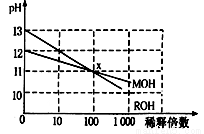
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
D
【解析】
试题分析:A、由图可知,稀释100倍后ROH溶液的pH由13降低到11,减小2,所以ROH为强碱,正确;B、MOH溶液稀释100倍后溶液的pH从12降低到11,减小1<2,说明MOH是弱碱,存在电离平衡,所以x点MOH未完全电离,正确;C、x点时,两种溶液的pH相同,则氢离子、氢氧根离子都相同,根据电荷守恒定律,则c(M+)=c(R+),正确;D、未稀释时,ROH溶液的pH=13,MOH的pH=12,前者氢氧根离子浓度是后者的10倍,但MOH是弱碱,存在电离平衡,则 MOH溶液的浓度应大于ROH溶液浓度的0.1倍,即稀释前,c(ROH)<10c(MOH),错误,答案选D。
考点:考查电解质强弱的分析,对图像的判断


科目:高中化学 来源:2014-2015学年广东省茂名市高三一模考试理综化学试卷(解析版) 题型:填空题
(16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) H1=a kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=b kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H= kJmol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K= 。
③关于上述反应,下列叙述不正确的是 (填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。

(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图

请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:实验题
(16分)Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为
2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。

(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:


基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。下列说法正确的是
元素代号 | X | W | Y | Z | Q |
原子半径(×10-12 m) | 37 | 64 | 66 | 70 | 154 |
主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,一定是共价分子
D.Y与W形成的化合物中,Y显负价
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质中,属于弱电解质的是
A.氯化氢 B.碳酸氢钠 C.一水合氨 D.二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法中正确的是
A.标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA。
B.常温下,pH=l的H2SO4溶液中含有的H+的数目为0.1NA。
C.标准状况下,2.24 L SO3中含有硫原子的数目为NA。
D.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研
究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在140 ℃左右与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -80 | 135.6 | 遇水生成HCl、SO2、S;300 ℃以上完全分解; S2Cl2+Cl2 |
| SCl2 | -78 | 59 | 略 |
设计实验装置图如右:
(1)右图中装置不够完善在G与H之间缺少 ___________装置。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式___________________________________;
E中反应的化学方程式____________________________________。
(3)C、D中的试剂分别是______________、_____________。
(4)仪器A、B的名称是_______、_______,在实验实施时F导管应较长,其目的是_____。
(5)如果在加热E时温度过高,对实验结果的影响___________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种)___________、__________,为了提高S2Cl2的纯度,关键的操作是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓
D.钠与水的反应:Na+H2O=Na++OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com