
| A. | 二氧化碳 碳酸钠 | B. | 硫酸钠 乙醇 | ||
| C. | 氧化铝 硫 | D. | 盐酸 蔗糖 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是指在水溶液和熔化状态下都不能导电的化合物,包括非金属氧化物、一些氢化物和大多数有机物;
单质和混合物既不是电解质也不是非电解质.
解答 解:A.二氧化碳在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导致导电,不是二氧化碳自身电离,所以二氧化碳是非电解质,碳酸钠是电解质,故A错误;
B.硫酸钠是盐,属于电解质,乙醇是非电解质,故B正确;
C.氧化铝是电解质,硫是单质,既不是电解质,也不是非电解质,故C错误;
D.盐酸是氯化氢的水溶液,属于混合物,既不是电解质,也不是非电解质,蔗糖是非电解质,故D错误;
故选B.
点评 本题考查了电解质和非电解质的判断,把握概念是解题关键,注意单质和混合物既不是电解质,又不是非电解质.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 20.0mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
| Ⅰ | 5% | 2.0g | 20℃ | |
| Ⅱ | 5% | 1.0g | 20℃ | |
| Ⅲ | 10% | 1.0g | 20℃ | |
| Ⅳ | ω | 2.0g | 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

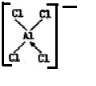 ,[AlCl4]的立体构型名称为正四面体形.
,[AlCl4]的立体构型名称为正四面体形. ,铍与铝元素性质相近的原因是Be与Al的电负性相近.
,铍与铝元素性质相近的原因是Be与Al的电负性相近.查看答案和解析>>
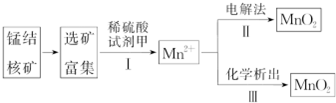
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4C1溶液因水解而显酸性,故NH4C1是弱电解质 | |
| B. | 纯碱溶液因水解而显碱性,水解的离子方程式为:CO32-+H2O?H2CO3+2OH- | |
| C. | 可乐因含碳酸而显酸性,电离方程式为:H2CO3?CO32-+2H+ | |
| D. | 配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
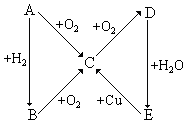 根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.
根据如图所示的A、B、C、D、E五种物质的相互转化关系,按如下要求填写相应的物质和有关反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
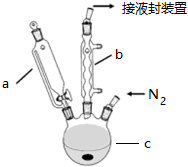
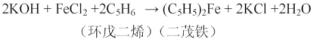
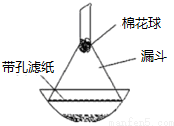
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com