
| A. | CO2分子的比例模型示意图为: | B. | 硫原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | 乙烯分子的结构式: |
分析 A.CO2分子,C原子半径大于O原子半径,二氧化碳分子结构为直线型;
B.原子中核电荷数=核外电子数;
C.溴化钠是离子化合物,是由阴阳离子构成的;
D.乙烯分子中碳原子之间形成2对共用电子对,碳原子与氢原子形成1对共用电子对,用短线“-”代替共用电子对为结构式.
解答 解:A.碳和氧位于同一周期,从左到右原子半径逐渐减小,故碳的原子半径较大,CO2分子比例模型: ,故A错误;
,故A错误;
B.硫原子的结构示意图 ,故B错误;
,故B错误;
C.溴化钠是离子化合物,是由阴阳离子构成的,电子式为 ,故C错误;
,故C错误;
D.乙烯分子中碳原子之间形成2对共用电子对,碳原子与氢原子形成1对共用电子对,结构式为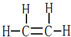 ,故D正确.
,故D正确.
故选D.
点评 本题考查了化学用语,涉及分子模型、电子式的书写、原子结构示意图、结构式等知识点,注意离子化合物和共价化合物电子式的区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 给手机充电时:化学能转化为电能 | |
| B. | 铅蓄电池的放电过程:电能转化为化学能 | |
| C. | 氢气在氧气中燃烧:化学能转化为热能和光能 | |
| D. | 植物的光合作用:生物质能(化学能)转化为光能(太阳能) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应属于置换反应 | D. | 生成1 mol N2有3 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水结成冰体积膨胀与氢键的作用有关 | |
| B. | DNA中的碱基互补配对是通过氢键来实现的 | |
| C. | 纯硫酸是一种粘稠状液体与分子间存在氢键有关 | |
| D. | HF、HCl、HBr、HI的熔点随相对分子质量增大而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ③④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
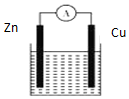
| A. | 产生1 g H2,消耗锌的质量65 g | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置不可实现化学能全部转化为电能 | |
| D. | 铜做正极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焦炭在氧气中燃烧所得到的产物 | |
| B. | 从市场上购得的漂白粉 | |
| C. | 实验室用MnO2固体和浓盐酸反应,从气体发生装置中导处的气体 | |
| D. | 将氟气与氢气以等物质的量,在冷暗处充分混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上“固定”和利用CO2能有效地减轻“温室效应”.
工业上“固定”和利用CO2能有效地减轻“温室效应”.| 物质的化学式 | CH3COOH | HCO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com