
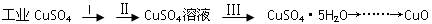
科目:高中化学 来源:不详 题型:填空题
 等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g)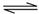 Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存。 |
 溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。
溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
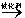 R-Cl(液)+HCl(气)制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
R-Cl(液)+HCl(气)制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题: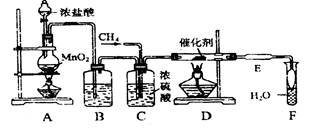
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
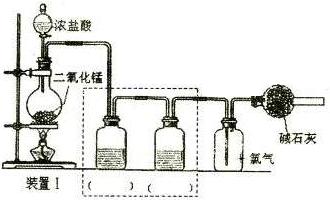
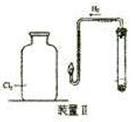
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液 |
B.乙烷(乙烯):用浓溴水洗气 |
C.乙醇(乙酸):用NaOH溶液中和后分液 |
D.乙醇(水):用生石灰吸水后蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
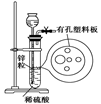
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com