
下列说法正确的是(N0表示阿伏加德罗常数的值)( )
①在常温常压下,11.2L N2含有的分子数为0.5N0
②在常温常压下,1mol Ne含有的原子数为N0
③71g Cl2所含原子数为2N0
④在同温同压时,相同体积的任何气体单质所含的原子数相同.
|
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
考点:
阿伏加德罗常数;气体摩尔体积.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
①在常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算N2的分物质的量;
②稀有气体为单原子分子,1molNe含有1mol原子;
③71g Cl2的物质的量为1mol,含有2mol氯原子;
④在同温同压时,相同体积的任何气体单质所含的分子数相同,但是气体分为单原子、双原子和多原子.
解答:
解:①在常温常压下,不能使用标况下的气体摩尔体积计算11.2L N2的物质的量及分子数,故①错误;
②在常温常压下,1mol Ne含有1mol氖原子,含有的原子数为N0,故②正确;
③71g Cl2所含原子的物质的量为2mol,含有的原子数为2N0,故③正确;
④在同温同压时,相同体积的任何气体单质所含的分子数相同,由于不同的气体分子中组成的原子数目可能不同,所以不一定含有相同的原子数,故④错误;
故选B.
点评:
本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,②为易错点,注意稀有气体为单原子分子.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
下列反应可能会生成Na2O2的是( )
A. 金属钠高温还原CO2,制人工金刚石膜或粉
B. 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠
C. 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O
D. 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 在离子化合物中不可能存在非极性键 |
|
| B. | 气体单质分子中一定存在非极性键 |
|
| C. | 在共价化合物中不可能存在离子键 |
|
| D. | 由非金属元素组成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)BCl3和NCl3中心原子的杂化方式分别为 和 .第一电离能介于B、N之间的第二周期元素有 种.
(2)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是 .
(3)BF3与一定量水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及 (填序号).
a.离子键 b.共价键 c.配位键 d.氢键e.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列仪器能直接用酒精灯加热的是( )
①量筒 ②表面皿 ③烧杯 ④试管 ⑤烧瓶 ⑥蒸发皿 ⑦坩埚.
|
| A. | ②③④⑥⑦ | B. | ③④⑥⑦ | C. | ④⑥⑦ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能大量共存,加入OH﹣有沉淀生成,加入H+有气体生成的一组离子是( )
|
| A. | K+、Mg2+、Cl﹣、HCO3﹣ | B. | K+、Cu2+、SO42﹣、Na+ |
|
| C. | NH4+、CO32﹣、NO3﹣、Na+ | D. | NH4+、Cl﹣、HCO3﹣、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) 熔化K2SO4⑨纯水.请回答下列问题(用序号):
(1)以上物质中能导电的是
(2)以上物质属于电解质的
(3)以上物质中属于非电解质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为:

以邻苯二酚为原料合成迷迭香酸的路线为:

下列说法正确的是( )
|
| A. | 有机物A分子中所有原子一定在同一平面上 |
|
| B. | 有机物B可以发生取代、加成、消去、氧化反应 |
|
| C. | 有机物C在稀硫酸催化下水解的一种产物是B |
|
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金。
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。

(1)此配合物中,铁离子的价电子排布式为 。
(2)此配合物的-C2H5中C-H间形成化学键的原子轨道分别是 ; 。
Ⅱ.(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体互为等电子体的离子的化学式为 (写出一个即可)。
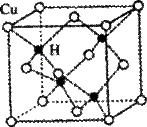
(2)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。已知CuH晶体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
Ⅲ.硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为 ,B原子的杂化类型为 。
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为 ,微粒间存在的作用力为 。

(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。

①1 mol H3BO3的晶体中有 mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2O·B(OH)3,它电离生成少量[B(OH)4]- 和的H+ 离子。则硼酸为 元酸,[B(OH)4]-含有的化学键类型为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com