
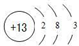
 ;B和C形成的化合物的电子式为
;B和C形成的化合物的电子式为 ;
;分析 短周期元素A、B、C、D、E的原子序数依次增大,E-的电子层结构与Ar原子相同,则E为Cl元素,B和E同主族,故B为F元素,1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,故C的价电子数为$\frac{0.5mol×1}{1mol}$=1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素;D的原子序数大于钠,D原子最外层电子数等于其周期序数,则D为Al.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,E-的电子层结构与Ar原子相同,则E为Cl元素,B和E同主族,故B为F元素,1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,故C的价电子数为$\frac{0.5mol×1}{1mol}$=1,处于第ⅠA族,原子序数大于F元素,故C为Na元素,A元素的最高正价和最低负价的绝对值之差为2,A最外层电子数为5,原子序数小于F原子,故A为N元素;D的原子序数大于钠,D原子最外层电子数等于其周期序数,则D为Al.
(1)D为Al,原子结构示意图为 ;B和C形成的化合物为NaF,电子式为
;B和C形成的化合物为NaF,电子式为 ,
,
故答案为: ;
; ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故简单离子的半径大小为 r(F-)>r(Na+)>r(Al3+),
故答案为:r(F-)>r(Na+)>r(Al3+);
(3)①单质铜与稀硝酸稀溶液反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
②氯气与氢氧化钠溶液反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)A.单质的颜色属于物理性质,不能比较元素非金属性强弱,故A错误;
B.非金属性与氢化物稳定性一致,故B正确;
C.同主族自上而下非金属性减弱,故C正确;
D.同主族原子半径越小,对电子吸引越强,非金属性越强,故D正确;
E.F元素没有+7价含氧酸,故E错误,
故选:AE.
点评 本题考查结构性质位置关系应用,关键是推断元素,注意对元素化合物性质的掌握,注意金属性、非金属性强弱比较实验事实.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:多选题
| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 实验方法 |
| 测定某工业废水的酸碱度 | |
| 检验自来水中残余氯分子 | |
| 检验CO2气体中含有的SO2 | |
| 除去FeCl2中的少量FeCl3 | |
| 除去NO中混有的少量NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | O2和O3互为同素异形体 | B. | O3是由3个氧原子构成的化合物 | ||
| C. | O2和O3相互转化属于化学变化 | D. | O3的摩尔质量为48g.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


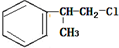 、
、 ;
;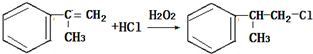

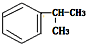 的一种同分异构体D符合以下条件:①苯环上有两条侧链 ②苯环上的一氯代物有2种,则D的结构简式为
的一种同分异构体D符合以下条件:①苯环上有两条侧链 ②苯环上的一氯代物有2种,则D的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
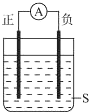
| A. | 正极Cu,负极Al,S为浓HNO3 | B. | 正极Ag,负极Al,S为NaOH | ||
| C. | 正极Ag,负极Cu,S为浓HCl | D. | 正极Zn,负极Cu,S为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成原电池时,铁作负极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铁经导线流向铜 | |
| D. | 铁铆钉发生了化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
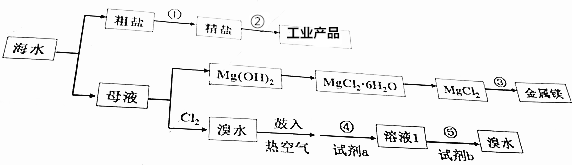
| A. | 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaO溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸 | |
| B. | 步骤②的工业产品包括:H2、Cl2、NaOH、Na | |
| C. | 步骤③的方法为点解饱和MgCl2溶液 | |
| D. | 步骤④、⑤中,若试剂a为SO2水溶液,则试剂b可以是Cl2 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:回答下列问题:

(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
① ZnFe2O4中Fe的化合价是___________,从物质分类角度说,ZnFe2O4属于__________(填“酸”、“碱”或“盐”)。
② 工业上利用反应ZnFe2(C2O4)3·6H2O ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是_________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。该反应中氧化产物是_________(填化学式),每生成1mol ZnFe2O4,转移电子的物质的量是___________。
(2)酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率。为达到这一目的,还可采用的措施是___________(任答一条);已知ZnFe2O4能溶于酸,则酸浸后溶液中存在的金属离子有______________。
(3)净化Ⅰ中H2O2参与反应的离子方程式为_______________;试剂X的作用是___________。
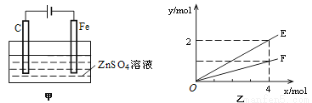
(4)钢铁镀锌是钢铁防护的一种有效方法。按图甲装置进行模拟铁上镀锌的实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量。
① C电极的电极反应式为______________________________。
② E可以表示的量是_________________________(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com