
| A. | 复分解反应 | B. | 置换反应 | C. | 化合反应 | D. | 分解反应 |
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Fe3+ | C. | Fe2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②④ | C. | 只有② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10min内,X的平均反应速率为0.03mol/(L•min) | |
| B. | 若容器中的气体密度不再发生变化,说明上述反应已达平衡状态 | |
| C. | 10min后Z的浓度为0.7mol/L | |
| D. | 10min内,反应放出的热量为0.3aKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
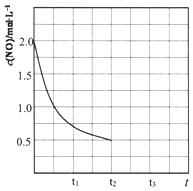 环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.
环境问题已成为人类共同关注的话题,燃煤废气、汽车尾气中的氮氧化物(NOx)、CO等有害气体,消除方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com