
 ���ú˴Ź������ⶨ�л�����ӵ���ά�ṹ���о������2002��ŵ������ѧ�������л�������У���ͬ��ԭ�ӵĺ˴Ź������и����ķ�ֵ���źţ�Ҳ��ͬ�����ݷ�ֵ���źţ�����ȷ���л����������ԭ�ӵ��������Ŀ��
���ú˴Ź������ⶨ�л�����ӵ���ά�ṹ���о������2002��ŵ������ѧ�������л�������У���ͬ��ԭ�ӵĺ˴Ź������и����ķ�ֵ���źţ�Ҳ��ͬ�����ݷ�ֵ���źţ�����ȷ���л����������ԭ�ӵ��������Ŀ������ ��1���˴Ź��������з�ֵ�������л�������ԭ�ӵ���������
��2��������C2H4Br2�Ľṹ�����֣�CH3CHBr2��CH2Br-CH2Br��ǰ����2����ԭ�ӣ�������1��Hԭ�ӣ���ͼ��֪A�ĺ˴Ź�������ֻ��1�����շ壬��AΪCH2Br-CH2Br��BΪCH3CHBr2��
��3��̼������������52.16%���������������13.14%������Ԫ�����������ǣ�1-52.16%-13.14%=34.7%�����������̼���⡢��ԭ�Ӹ���֮��=$\frac{52.16%}{12}$��$\frac{13.14%}{1}$��$\frac{34.7%}{16}$=2��6��1��ʵ��ʽC2H6O��Hԭ���Ѿ�����C���ļ۽ṹ���ʷ���ʽΪC2H6O����Ϻ��еĻ�ѧ����д�ṹ��ʽ��
��� �⣺��1���˴Ź���������ֻ��һ�ַ壬˵����������1��Hԭ�ӣ����顢�����ѷ�������1��Hԭ�ӣ���������������������ж�����2��Hԭ�ӣ���AD��ȷ��BC����
�ʴ�Ϊ��AD��
��2��������C2H4Br2�Ľṹ�����֣�CH3CHBr2��CH2Br-CH2Br����ͼ��֪A�ĺ˴Ź�������ֻ��1�����շ壬��A������ֻ��1��Hԭ�ӣ�A�Ľṹ��ʽΪBrCH2CH2Br��A��B����ʽ��ͬ����BΪ�Ľṹ��ʽΪBr2CHCH3����������2��Hԭ�ӣ�
�ʴ�Ϊ��BrCH2CH2Br��2��
��3��̼������������52.16%���������������13.14%������Ԫ�����������ǣ�1-52.16%-13.14%=34.7%����M��̼���⡢��ԭ�Ӹ���֮��=$\frac{52.16%}{12}$��$\frac{13.14%}{1}$��$\frac{34.7%}{16}$=2��6��1��ʵ��ʽC2H6O��Hԭ���Ѿ�����C���ļ۽ṹ����M����ʽΪC2H6O�������������ͼ��֪M�к���O-H��C-O��C-H������M�Ľṹ��ʽΪCH3CH2OH��
�ʴ�Ϊ��C2H6O��CH3CH2OH��
���� ���⿼���л������ʽ�ļ��㡢�л���ṹȷ������Ŀ�ѶȲ����ܶԳ�����ͼ���м��Ķ�ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���������ƹ��������ֽ�ϳ��� | |
| B�� | ��10ml��Ͳ��ȡ8.58ml����ˮ | |
| C�� | ����ƿ����ʱ�۲�Һ��ʱ���ӣ���ʹ��õ���ҺŨ��ƫ�� | |
| D�� | ��������ƽ���Գ�����0.1g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ������ | �����Լ� | ������Ӧ�����ӷ���ʽ |
| A | Fe3+��S2����Cl����Na+ | NaOH��Һ | Fe3++3OH���TFe��OH��3�� |
| B | H+��Fe2+��SO42����NO3�� | BaCl2��Һ | SO42��+Ba2+�TBaSO4�� |
| C | Na+��Al3+��Cl����SO42�� | ����KOH��Һ | Al3++3OH���TAl��OH��3�� |
| D | Na+��K+��ClO����SO42�� | ͨ������SO2 | 2ClO��+SO2+H2O�T2HClO+SO32�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������̼������Һ��� | �������Ȼ�����Һ��� | ������̼��������Һ��� | CO2ͨ��CaCl2��Һ |
| A | B | C | D |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1��2��2-�ļ����� | B�� | 3-��-1��3-����ϩ | ||
| C�� | 2��4��6-�������ױ� | D�� | 2-��-3-���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
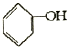 �ϳ�
�ϳ�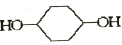 ���������Լ��ͷ�Ӧ��������ȥ��
���������Լ��ͷ�Ӧ��������ȥ��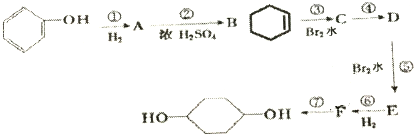
 ��E
��E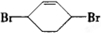 ��
��
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ѧ��Ӧ�����ͷŵ������ڹ�ҵ�����Ϳ�ѧ�о���������Ҫ�����ã�
��ѧ��Ӧ�����ͷŵ������ڹ�ҵ�����Ϳ�ѧ�о���������Ҫ�����ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
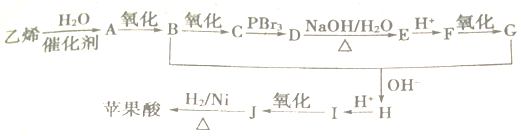
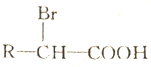
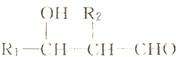
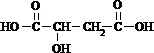 +2NaHCO3��
+2NaHCO3��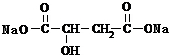 +2CO2��+2H2O��
+2CO2��+2H2O�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{1000{��}_{1}{��}_{2}��}{182.5}$mol/L | B�� | $\frac{1000{��}_{1}{��}_{2}��}{{��}_{1}+4}$mol/L | ||
| C�� | $\frac{1000{��}_{1}{��}_{2}��}{36.5��{��}_{1}+4��}$mol/L | D�� | $\frac{1000{��}_{1}��}{182.5}$mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com