
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
【答案】FeTiO3 FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O10 TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+TiO2+2C+2Cl2=TiCl4+2CO隔绝空气
【解析】
钛铁矿用浓硫酸溶解,反应的主要产物是TiOSO4和FeSO4,向所得溶液中加入大量水稀释后加入过量的铁粉还原铁离子,过滤得到滤液通过蒸发浓缩,冷却结晶,过滤得到溶液中 含有亚铁离子、TiO2+和少量镁离子等阳离子,冷却结晶得到副产品主要为硫酸亚铁,滤液中加入水加热过滤得到H2TiO3 ,H2TiO3加热灼烧得到TiO2,加入氯气、过量碳高温下反应生成四氯化钛和一氧化碳,四氯化钛和金属镁高温下反应得到氯化镁和钛金属。(1). 钛酸亚铁与碳在高温下反应的化学方程式,根据原子守恒,钛酸亚铁的化学式为FeTiO3 ,钛酸亚铁和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成还生成硫酸亚铁和水,该反应的化学方程式为FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;(2) ①加入过量的铁粉还原铁原子,防止亚铁离子被氧化为铁离子,溶液中镁离子的物质的量浓度为0.0018mol/L,析出氢氧化镁时,溶液中的c(OH-)= mol/L=10-4mol/L,则溶液中的氢离子浓度为10-10mol/L,则溶液的pH=10;②TiO(OH)2的溶度积最小,溶液加水稀释析出的白色沉淀为TiO(OH)2,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+; (3). 乙为TiO2,与氯气和过量的碳高温加热反应生成TiCl4和一氧化碳,反应方程式为:TiO2+2C+2Cl2=TiCl4+2CO,镁能与空气中氧气、氮气反应,需要隔绝空气进行。
mol/L=10-4mol/L,则溶液中的氢离子浓度为10-10mol/L,则溶液的pH=10;②TiO(OH)2的溶度积最小,溶液加水稀释析出的白色沉淀为TiO(OH)2,该反应的离子方程式为TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+; (3). 乙为TiO2,与氯气和过量的碳高温加热反应生成TiCl4和一氧化碳,反应方程式为:TiO2+2C+2Cl2=TiCl4+2CO,镁能与空气中氧气、氮气反应,需要隔绝空气进行。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等,W元素的主族序数和周期数相同。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我们的日常生活中出现了“加碘食盐”“铁强化酱油”“高钙牛奶”“含氟牙膏”等商品。这里的碘、铁、钙、氟应理解为
A.元素B.单质C.分子D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 相同温度时,气体分子间的距离一定相等
B. 2gH2和2gO2能恰好反应生成4gH2O
C. 3.2gO3中含有的氧原子数为1.204×1023个
D. 1 mol·L-1 MgCl2溶液中含Cl-数为1.204×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.60gCuSO4固体置于下图所示的装置(固定及夹持类仪器未画出)中加热到1100℃,使其分解,分解过程中可以观察到:石英管中固体由白色变为黑色,最终变为红色;BaCl2溶液中生成白色沉淀,品红溶液褪色,集气瓶中收集到无色气体。
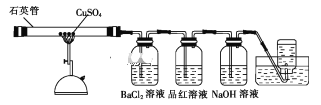
(1)石英主要成分的化学式是_____;高温分解CuSO4固体使用石英管而不使用普通玻璃管的原因是_____。
(2)石英管中剩余红色固体质量为0.72 g,经检测为不含硫元素的纯净物。则该固体的化学式为__。
(3)将BaCl2溶液中生成的白色沉淀过滤并洗涤,向洗涤后的沉淀中加入稀盐酸,无明显现象。
①沉淀的化学式为_____。
②检验沉淀是否洗净的方法是___。
(4)若NaOH溶液足量,则其中发生反应的离子方程式为____。
(5)集气瓶中收集的无色气体是____(填化学式),检验该气体的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com