
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:CO >Y->X->HCO
>Y->X->HCO
D.HX和HY酸性相同,都比H2CO3弱
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面都产生了深远的影响,请完成(1)~(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO 4)跟铁反应生成铜]。试写出该反应的化学方程式:
4)跟铁反应生成铜]。试写出该反应的化学方程式:
________________________________________________________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:________________________________________________________________________,
这层铜绿可以用化学方法除去。试写出除去铜绿而不损伤器物的化学方程式:________________________________________________________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币:_____________________________________________________
________________________________________________________________________
________________________________________________________________________。
(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列制备金属单质的方法或原理正确的是 ( )
A.在高温条件下,用H2还原MgO制备单质Mg
B.在通电条件下,电解熔融Al2O3制备单质Al
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙为单质,丙、丁为化合物,它们之间存在如图所示的转化关系。
(1)若甲、乙均为非金属,丙为氧化物,则:
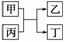 ①乙为氧化产物时,乙可能是________(填化学式,下同),按照元素周期表推测,此时反应物甲可能是__________________________________。
①乙为氧化产物时,乙可能是________(填化学式,下同),按照元素周期表推测,此时反应物甲可能是__________________________________。
②乙为还原产物时,丁所属的物质类别是___________________________________。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式:__________________________________。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,水的电离达到平衡:H2OH++OH-。下列叙述正确的是( )
A.将水加热,平衡向正反应方向移动,KW不变
B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列有关醋酸的叙述中不正确的是( )
A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.浓度均为0.1 mol·L-1的CH3COOH溶液和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
C.将pH=a的醋酸稀释为pH=a+1的过程中, 不断减小
不断减小
D.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠在工业生产中用途非常广泛。
(1) 溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的
溶液是定量实验中的常用试剂。实验室需用480mL一定浓度的 溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外,还需__________________。
(2) 可以用作氰化物的解毒剂,工业上常用硫化碱法制备
可以用作氰化物的解毒剂,工业上常用硫化碱法制备 ,反应原理为:
,反应原理为:

某研究小组在实验室模拟该工业原理制备 ,部分实验装置如下:
,部分实验装置如下:

①装置B的作用是检验装置A中 的吸收效率,则B中试剂是________________,
的吸收效率,则B中试剂是________________,
表明 吸收效率低的实验现象是B中溶液________________________。
吸收效率低的实验现象是B中溶液________________________。
②实验结束时,测得装置C中的溶液含有两种溶质,其中一种为NaOH,则实验过程中该装置内发生反应的化学方程式是_________________________;若两种溶质的物质的量相等,则该溶液所含离子浓度的大小顺序为__________________________________。
③假设本实验所用的 含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
含少量NaC1、NaOH,设计实验方案进行检验。请完成下表。
已知:室温时CaCO3饱和溶液的pH=10.2。
限选试剂及仪器:稀硝酸、AgNO3溶液、CaC12溶液、酚酞溶液、蒸馏水、pH计,烧杯、试管、胶头滴管。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com