
| A. | Al3+ Na+ AlO2- Cl- | B. | K+ Na+ Cl- CO32- | ||
| C. | Fe3+ Na+ Cl- HCO3- | D. | SO42- Fe2+ H+ NO3- |
科目:高中化学 来源: 题型:填空题
 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图),仔细观察,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
| D | 向水玻璃溶液中通入足量CO2 后,产生白色浑浊 | 生成了硅酸沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
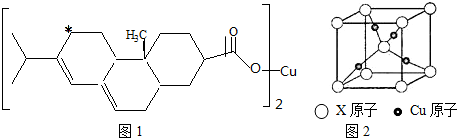
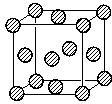 ,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
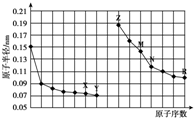
| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | 简单离子的半径:M<Z<X | |
| D. | X、N两种元素组成的化合物一定不与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
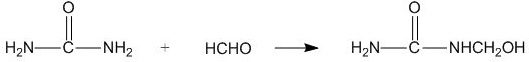
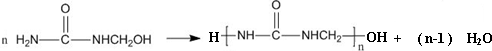
| A. | 合成脲醛塑料的反应为加聚反应 | |
| B. | 尿素与氰酸铵 ( NH4CNO ) 互为同系物 | |
| C. | 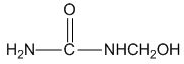 能发生水解反应 能发生水解反应 | |
| D. | 脲醛塑料平均相对分子质量为10000,平均聚合度为111 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com