
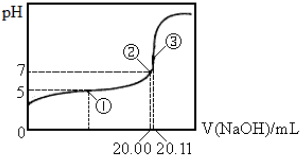
分析 (1)①为缓冲溶液,pH=pKa-lg$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$,据此计算电离平衡常数;
(2)Na2CO3第一步水解反应的水解常数的表达式:Kh=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$;
(3)该反应的平衡常数K=$\frac{{c}^{2}(N{{H}_{4}}^{+})}{c(M{g}^{2+}).{c}^{2}(N{H}_{3}.{H}_{2}O)}$,Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$,Ksp[Mg(OH)2]=c(Mg 2+).c2(OH-).
解答 解:(1)①为缓冲溶液,pH=pKa-lg$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$,5=pKa+lg2,则Ka=2×10-5,故答案为:2×10-5;
(2)Na2CO3第一步水解反应的水解常数的表达式:Kh=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,
故答案为:$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$;
(3)该反应的平衡常数K=$\frac{{c}^{2}(N{{H}_{4}}^{+})}{c(M{g}^{2+}).{c}^{2}(N{H}_{3}.{H}_{2}O)}$,Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$,Ksp[Mg(OH)2]=c(Mg 2+).c2(OH-),所以K=$\frac{{c}^{2}(N{{H}_{4}}^{+})}{c(M{g}^{2+}).{c}^{2}(N{H}_{3}.{H}_{2}O)}$=$\frac{{{K}_{b}}^{2}}{c(M{g}^{2+}).{c}^{2}(O{H}^{-})}$=$\frac{{{K}_{b}}^{2}}{{K}_{sp}}$,
故答案为:K=$\frac{{{K}_{b}}^{2}}{{K}_{sp}}$.
点评 本题考查化学平衡常数有关计算、缓冲溶液pH的计算等知识点,为高频考点,侧重考查学生知识灵活运用能力,明确各个物理量之间的关系式是解本题关键,难点是(3)中各个物理量的等量代换,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,气体体积大小取决于气体分子的大小 | |
| B. | 一定条件下,气体体积大小取决于其物质的量的多少 | |
| C. | 1mol任何气体所占的体积为22.4L,称为气体摩尔体积 | |
| D. | 体积不相等的两种气体所含的分子数也一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 +Br2$\stackrel{催化剂}{→}$
+Br2$\stackrel{催化剂}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuCl2(无水CuSO4) | B. | NaOH(H2O) | C. | NaCl(HCl气体) | D. | CuSO4(Cu(OH)2固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com