

| A. | 若最终有气体剩余,气体呈红棕色 | B. | 若最终有气体剩余,气体是NO | ||
| C. | 试管内溶液为稀的硝酸溶液 | D. | 试管内的液面高度肯定会上升 |
分析 试管内装有NO,然后间歇而缓慢地通入O2,当一氧化氮和氧气恰好反应生成硝酸发生的反应为:4NO+3O2+2H2O=4HNO3,结合一氧化氮和氧气按照4:3全部溶于水进行定性分析.
解答 解:A、二氧化氮与水反应生成硝酸和一氧化氮,所以如果最终有气体剩余,气体也不可能呈红棕色,故A错误;
B、若最终有气体剩余,气体可能是NO,故B正确;
C、4NO+3O2+2H2O=4HNO3,所以试管内溶液为稀的硝酸溶液,故C正确;
D、一氧化氮、氧气和水反应生成硝酸,随气体的量减少,试管内压强变小,导致液面在不停上升,故D正确;
故选A.
点评 本题考查了一氧化氮和氧气混合溶于水反应的定性关系分析,掌握物质性质和相关化学反应是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 取样品进行焰色反应,火焰显黄色,说明有Na元素存在,无K元素 | |
| B. | 向某溶液中滴入稀盐酸立即产生使澄清石灰水变浑浊的气体,说明有CO32-存在 | |
| C. | 向某溶液中滴入KSCN溶液不变色,再滴入几滴氯水变红,说明存在Fe2+,无Fe3+ | |
| D. | 向某溶液中滴加过量Ba(0H)2溶液,最终有白色沉淀,说明无Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | XY2与ZY2中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
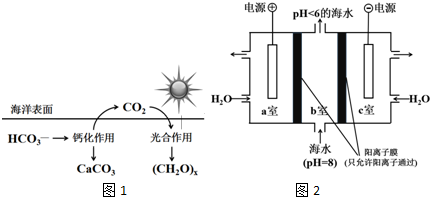
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 分子数 | C. | 体积 | D. | 物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3+3CH4↑ | |
| C. | 根据化合价Fe3O4可表示为FeO•Fe2O3,则Pb3O4也表示为PbO•Pb2O3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
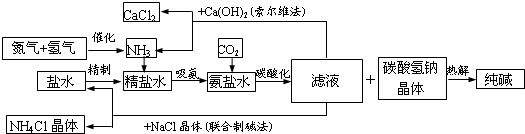
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.05NA | |
| B. | 常温下,1 L0.1mol/L的Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| C. | 标准状况下,22.4 L CO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1mol FeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 将等浓度的CH3COOH和HClO溶液,pH小的是HClO | |
| B. | Na2CO3和NaHCO3溶液中粒子种类不同 | |
| C. | 溶液水的电离程度①>②>④>③ | |
| D. | NaHCO3溶液中,c(Na +)=c(CO3 2-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com