
某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质R,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;
假设B:__________________________________________________________;
假设C:__________________________________________________________。
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中 加KSCN溶液 | | 固体物质中有FeCl3 |
| ②向R溶液中滴加 酸性KMnO4溶液 | | 固体物质中不含FeCl2 |
(9分,每空1分)
(1)该固体物质是FeCl2; 该固体物质是FeCl3和FeCl2的混合物;(两空答案可相互交换)
(2)①溶液为血红色; ②KMnO4溶液紫色不褪色; A;
(3)Fe3++3SCN- Fe(SCN)3; =; 变深 ; (4)2Fe3++Cu = 2Fe2++Cu 2+
Fe(SCN)3; =; 变深 ; (4)2Fe3++Cu = 2Fe2++Cu 2+
解析试题分析:(1)根据类比法,结合假设A可知,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,即假设B是该固体物质是FeCl2;假设C是该固体物质是FeCl3和FeCl2的混合物。
(2)铁离子能和KSCN溶液反应使溶液显红色,因此固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红;亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,因此在酸性KMnO4溶液中加入少量固体R,KMnO4溶液颜色无明显变化,说明固体中不含还原性物质,即不含FeCl2,由此得出固体R是由氯化铁构成的,即假设A正确。
(3)氯化铁与KSC溶液反应的离子方程式为Fe3++3SCN- Fe(SCN)3;保持温度不变,继续滴加少量KSCN溶液,增大KSCN的浓度,平衡向正反应方向移动,因此溶液的红色加深。由于平衡常数只与温度有关系,所以K1=K2。
Fe(SCN)3;保持温度不变,继续滴加少量KSCN溶液,增大KSCN的浓度,平衡向正反应方向移动,因此溶液的红色加深。由于平衡常数只与温度有关系,所以K1=K2。
(4)铁离子具有氧化性,能把单质铜氧化生成铜离子,反应的离子方程式为2Fe3++Cu = 2Fe2++Cu 2+。
考点:考查氯气与铁反应产物的实验探究;亚铁离子和铁离子的检验;铁离子的性质;外界条件对平衡状态的影响等


科目:高中化学 来源: 题型:实验题
碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答如下问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+
(x+y)H2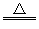 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O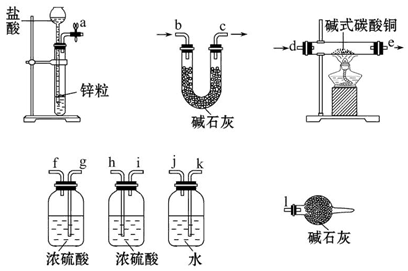
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g 残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为_____g,化学式为_____________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是 。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为 。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②____________________________________________________________________
(3)为使A中固体加快溶解速率,以下方法运用合理的是 。
a.对A装置加热;b.向A内加入少量Fe2O3;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO4;f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是 。
②检验溶液中铁元素是否被完全沉淀最好的方法是___________
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: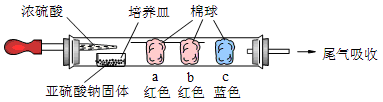
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 |  |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:
一是发生氧化还原反应 ① ;二是发生互促水解反应 ② 。
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色。这种红褐色液体是 ③ 。
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色。将所得溶液分成两等份:
其中一份加入KSCN溶液,溶液变成血红色,此步实验的目的是 ④ ;另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是 ⑤ 。
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同。
同学们由上述实验得出的结论是 ⑥ 。
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为 ⑦ ;检验的目的是 ⑧ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如下: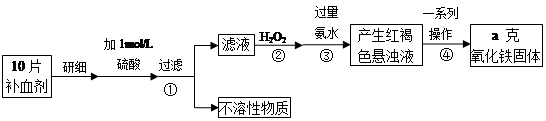
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被 (填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含 和 (填化学式).
(3)步骤④中一系列处理的操作步骤为 、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是 .
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为 .
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。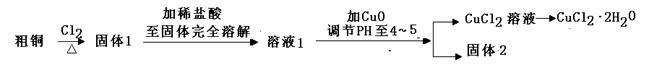
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。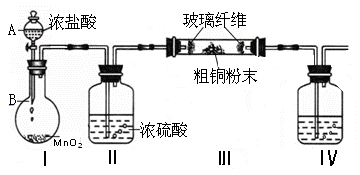
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq) CuCl42- (aq) +4H2O(l)
CuCl42- (aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b. 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
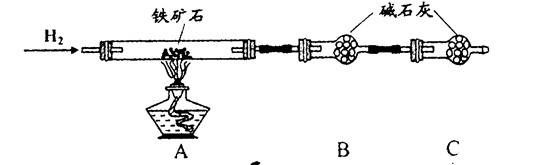
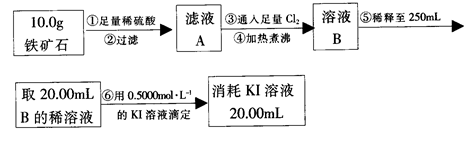
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定;
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品都为碱石灰(详见图示,夹持仪器省略)
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定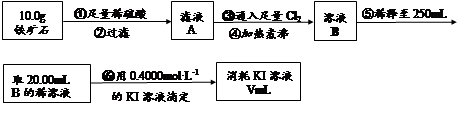
(3)步骤④中煮沸的作用是 。
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(5)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(6)若滴定过程中消耗0.4000mol·L?1KI溶液25.00ml,则铁矿石中铁的百分含量为 。
Ⅲ.(7)由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产生,则通入的气体可能是( )
| A.NH3 | B.Cl2 | C.CO2 | D.NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com