
下列说法错误的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;
若pH<7,则H2A是强酸
C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的
浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
在下列有关晶体的叙述错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.离子晶体中可能存在共价键 D.分子晶体中有可能存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
关于分子式为C5H10的烯烃的下列说法正确的是( )
A.该烯烃的一种同分异构体为CH2=CHCH(CH3)2名称为2-甲基-3-丁烯
B.其属于烯烃的同分异构体有5种
C.有一种同分异构体的名称为:2,2-二甲基-1-丙烯
D.该物质的结构简式最多有两个侧链
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镁及其化合物不仅在国防上有重要应用,在化学
研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:
取一段镁条,用砂纸擦去表面的氧化膜,使足量
镁条与一定量盐酸反应生成H2的量与反应时间
 的关系曲线如图所示。镁与盐酸反应的离子方程
的关系曲线如图所示。镁与盐酸反应的离子方程
式为 ;
在前4min内,镁条与盐酸的反应速率逐渐加快,
在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,
写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的描述中,正确的是
A.测定中和热时,一般用酚酞试液作指示剂
B.用酸式滴定管量取酸性高锰酸钾溶液5.10mL
C.酸碱中和滴定时,眼睛要密切注意滴定管中液面的刻度
D.用10mL的量筒准确量取8.05mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
安全是顺利进行实验的保障,下列实验处理或方法正确的是( )
A.含氯气的尾气用澄清石灰水吸收较好
B.把氢气和氯气混合光照制氯化氢
C.导管口点燃一氧化碳时也要验纯
D.重金属盐有毒,如果不慎食入氯化钡,喝入硫酸铜溶液即可
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图装置进行实验,并回答下列问题
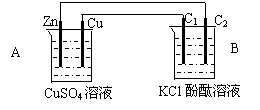 |
⑴锌极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
⑶当C2极析出224mL气体(标准状态)时,锌的质量减少_________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com