
【题目】H2O2既可以作氧化剂,又可以作还原剂。现向H2O2溶液中加入强酸酸化的KMnO4溶液,紫红色的KMnO4溶液变成了无色。该强酸性反应体系中,反应物和生成物共六种粒子:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。
(1)写出该反应离子方程式并配平: ____________________________________________________________________。
(2)该反应应选择的酸是:________________ (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(3)请将氧化剂与还原剂的化学式填入空格中,并标出电子转移的方向和数目__________________。
![]()
(4)如反应中电子转移了0.5 mol,则产生的气体在标准状况下的体积为_________L。
【答案】 2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O C 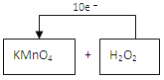 5.6
5.6
【解析】(1)H2O2溶液中加入用强酸酸化的KMnO4溶液,紫红色的MnO4-被还原成了无色Mn2+,则反应中H2O2应被氧化,生成氧气和水,则反应的方程式为为2KMnO4+5H2O2+3H2SO4→K2SO4+2MnSO4+5O2+8H2O,离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O
故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O;
(2)高锰酸钾具有强氧化性,不能选用还原性酸,可以选用稀硫酸,故选C;
(3)反应中Mn元素化合价由+7价降低到+2价,O元素化合价由-1价升高高0价,转移的电子的方向和数目可表示为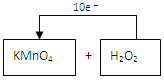 ,故答案为:
,故答案为: ;
;
(4)如反应中电子转移了0.5mol,则应生成0.25molO2,标准状况下的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2= Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-= CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中:FeS+2H+= Fe2++H2S↑
D.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三元素, 其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4, 则下列判断正确的是( )
A. 原子半径 X>Y>Z
B. 非金属性 X>Y>Z
C. 阴离子的还原性按X、Y、Z的顺序由强到弱
D. 气态氢化物的稳定性按X、Y、Z的顺序由弱到强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是
A. Q1<Q3<Q2 B. Ql<Q2<Q3
C. Q1<Q2=Q3 D. Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率: v(H2O2)≈3.3×10-2mol·L-1·min-1
B. 0~6 min的平均反应速率: v(H2O2)<3.3×10-2mol·L-1·min-1
C. 反应至6 min时,c(H2O2)=0.30 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产生活离不开金属材料,金属及金属材料在生产、生活中应用广泛.
(1)生活中常用的铁锅炒菜,主要是利用了铁的;铁在潮湿的空气中容易锈蚀,喷漆可以延缓汽车钢铁外壳的锈蚀,起防锈原理是隔绝 , 喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,写出其中涉及到的一个化学方程式: .
(2)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程: 
①A、B、C三种金属的活动性顺序为 .
②金属C是 , 已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的是初中化学中的一些重要实验.请回答下列问题: 
(1)实验A:测得空气中氧气体积分数小于 ![]() 的原因可能是(只答一条): .
的原因可能是(只答一条): .
(2)实验B:用玻璃棒搅拌的目的是 .
(3)实验C:集气瓶内放少量水的目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com