
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
分析 A、阴极上得电子发生还原反应;
B、惰性电极电解Na2SO4溶液,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算分析;
D、电解精炼时,粗铜作阳极.
解答 解:A、原电池中,负极失电子发生氧化反应,电解池中阴极上得电子发生还原反应,故A错误;
B、惰性电极电解Na2SO4溶液,实质是电解水,阳极是氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,阴阳两极产物的物质的量之比为2:1,故B错误;
C、惰性电极电解饱和NaCl溶液,阳极氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电极反应电子守恒计算2H++2e-=H2↑,若有1mol电子转移,氢离子减小1mol,溶液中氢氧根离子增加1mol,则生成1mol NaOH,故C正确;
D、电解精炼时,粗铜作阳极,粗铜失电子生成铜离子,电极反应式为:Cu-2e-=Cu2+,纯铜作阴极,铜离子在阴极得电子生成Cu,故D错误;
故选C.
点评 本题考查了原电池、电解池原理的分析应用,主要是电解名称、电极反应和电极产物的分析判断,掌握原理是关键,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
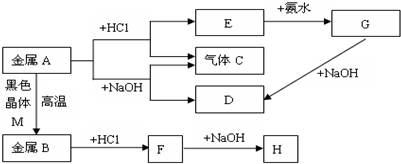
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ |
| 稀硝酸体积/mL | 100 | 200 | 300 |
| 剩余金属/g | 30.4 | 22 | 12.8 |
| NO体积/mL | 2240 | 4480 | 6720 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若保持温度,保持容器容积固定不变,向容器内补充B气体,则有a<b | |
| B. | 若保持温度、压强不变,充入惰性气体,则有a>b | |
| C. | 若其他条件不变,升高温度,则有a<b | |
| D. | 若a=b,则可能是在该温度下,保持容器容积固定不变情况下充入了惰性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极开发和利用新能源,减少煤、石油等化石燃料的使用量 | |
| B. | 明矾净水的原理和家用消毒液消毒的原理相同 | |
| C. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 | |
| D. | 雾霾的形成与工厂废气的排放有关,与汽车尾气无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和体积相同的CO和NO | B. | 同温同压下的CO和NO | ||
| C. | 质量相同,密度不同的 CO 与N2 | D. | 体积和压强都相同的CO和NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com