
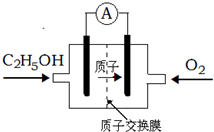
| A.放电过程中,电源内部的H+从正极区向负极区迁移 |
| B.通入乙醇的电极是负极 |
| C.该电池的正极反应为:4H++O2+4e-=2H2O |
| D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2molC2H5OH,阳极产生标准状况下气体的体积为26.88L |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.正极电极反应:O2+2H2O+4e-====4OH- |
B.负极电极反应:CH3OH+8OH--6e-====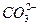 +6H2O +6H2O |
| C.电池在使用过程中电解质溶液的pH升高 |
| D.当外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn为正极,Ag2O为负极 | B.Zn为负极,Ag2O为正极 |
| C.原电池工作时,正极区溶液PH值减小 | D.原电池工作时,负极区溶液PH值增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。
2PbSO4 +2H2O。请依据上述情况判断:⑴铅蓄电池的负极材料是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4在负极发生氧化反应 |
| B.O2作为氧化剂发生还原反应 |
| C.甲烷燃料电池实现了化学能转变为电能 |
| D.分别将1molH2和CH4做燃料电池的原料,产生电量一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
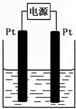
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
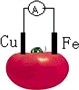
| A.铜片为负极 |
| B.铁片上发生还原反应 |
| C.该装置将电能转变为化学能 |
| D.电子由铁片沿导线流向铜极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com