
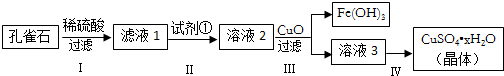
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeCO3、Si的化合物,加入稀硫酸反应后生成二氧化碳气体,过滤得到二氧化硅固体,得到滤液1为硫酸铜、硫酸亚铁溶液,“除杂”时先通入足量过氧化氢将Fe2+氧化成Fe3+,得到溶液2为硫酸铜、硫酸铁溶液,再加入CuO固体调节溶液pH,沉淀铁离子生成氢氧化铁沉淀;过滤得到滤液为硫酸铜溶液,滤液3为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体,
(1)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于除去,所加试剂能和亚铁离子反应且不能引入新的杂质;
(2)溶液中得到溶质的方法是蒸发浓缩、冷却结晶、过滤洗涤;
(3)NaClO与Fe(OH)3在强碱性条件下反应制得K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,结合电子、电荷守恒解答,在碱性锌电池中,锌做负极发生氧化反应,K2FeO4在正极发生还原反应生成氧化铁,据此书写电极反应式,注意电解质溶液为碱性溶液;
(4)步骤Ⅲ加入CuO目的是调节溶液的pH使铁离子沉淀完全,同时铜离子不沉淀,依据常温下Fe(OH)3和Cu(OH)2的溶度积常数计算溶液中的氢离子浓度,据此判断pH范围;
(5)称量粉末的质量为1.6g为硫酸铜质量,受热前后质量变化为结晶水的质量,结合化学方程式CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O计算x.
解答 解:(1)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于沉淀除去,所加试剂能和亚铁离子反应且不能引入新的杂质,
a.KMnO4溶液加入后,能氧化亚铁离子,但会引入钾离子、锰离子,故a错误;
b.加入H2O2会氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,故b正确;
c.Fe不具有氧化性,无法氧化亚铁离子,故c错误;
d.加入KSCN溶液结合铁离子形成络合物,不能氧化亚铁离子,亚铁离子的存在会干扰硫酸铜晶体的析出,故d错误;
故答案为:b;
(2)操作Ⅳ是溶液中得到硫酸铜晶体,不能直接蒸干,该操作方法为:蒸发浓缩、冷却结晶、过滤洗涤等,
故答案为:蒸发浓缩;冷却结晶;
(3)NaClO与Fe(OH)3在强碱性条件下反应制得K2FeO4,Fe元素的化合价升高,则Cl元素的化合价降低,由电子、电荷守恒可知离子反应为2Fe(OH)3+3C1O-+4OH-=2FeO42-+3C1-+5H2O,在碱性锌电池中,锌做负极发生氧化反应,K2FeO4在正极发生还原反应生成氧化铁,正极的电极反应式为:2FeO42ˉ+6eˉ+5H2O=Fe2O3+10 OH-,
故答案为:2Fe(OH)3+3C1O-+4OH-=2FeO42-+3C1-+5H2O;2FeO42ˉ+6eˉ+5H2O=Fe2O3+10 OH-;
(4)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0mol•L-1,c(Cu2+)=3.0mol•L-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20;c2(OH-)=$\frac{3.0×1{0}^{-20}}{3.0}$=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14;求的c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=$\frac{8.0×1{0}^{-38}}{1×1{0}^{-5}}$=8.0×10-33;求得c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14、c(H+)=5×10-4mol/L,则pH=3.3;
所以要除去Fe3+而不损失Cu2+溶液的pH范围是:3.3<pH<4,
故答案为:3.3<pH<4;
(5)称取2.4g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g为硫酸铜质量,n(CuSO4)物质的量=$\frac{1.6g}{160g/mol}$=0.01mol,受热质量减少2.4g-1.6g=0.8g,水的物质的量=$\frac{0.8g}{18g/mol}$=0.044mol;
CuSO4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O
1 x
0.01mol 0.044mol
$\frac{1}{0.01mol}$=$\frac{x}{0.044mol}$,
解得:x=4.4
故答案为:4.4.
点评 本题考查了制备方案的设计,题目难度中等,涉及物质性质的理解应用、电化学知识、溶液pH值的计算等,综合性强,掌握实验基本操作和流程分析是关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | Cl>S>F>O | D. | S2->O2->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
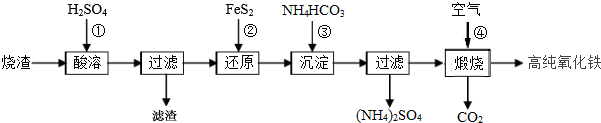
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用 | |
| B. | 离子化合物中的阳离子都是金属离子 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 凡是金属元素跟非金属元素化合都形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
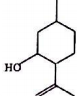
| A. | 其分子式为C10H18O | B. | 含有1个手性碳原子 | ||
| C. | 能发生消去反应 | D. | 可与FeCl3溶液反应显示紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物里,只存在离子键,没有共价键 | |
| B. | 非极性键只存在于双原子的单质分子中 | |
| C. | 任何物质里都含有化学键 | |
| D. | 在共价化合物分子内,一定不存在离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com