
 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷分析 (1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
(2)根据名称可知,在1号和2号碳原子之间有碳碳双键,在号碳原子上有一个甲基,据此写出结构简式;
(3)结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物;同系物判断规律:①一差:分子组成相差若干个CH2原子团,即相对分子质量差保持一致,犹如等差数列中的公差. ②一同:同通式.③一似:结构相似,据此进行判断.
解答 解:(1)烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,从离支链近的一端给主链上碳原子进行编号,则在3号和4号碳原子上各有一个甲基,在3号碳上含有一个乙基,故名称为:3,4-二甲基-3-乙基己烷,故答案为:3,4-二甲基-3-乙基己烷;
(2)依据系统命名方法,结合名称写出结构简式,4-甲基-2-乙基-1-戊烯的结构简式是:CH2=C(C2H5)CH2CH(CH3)2,故答案为:CH2=C(C2H5)CH2CH(CH3)2;
(3)同系物中含有的官能团种类和数目必须相同,②CH2=CHCl中含有一个碳碳双键,其它物质都没有,所以没有与②互为同系物的有机物;
④中含有两个氯离子,其它物质都含有1个或者不含氯原子,所以没有与④互为同系物的有机物;
⑤和⑥为烷烃,二者含有4个碳原子,属于同分异构体,不属于同系物;
只有①CH3CH2Cl和③CH3CH2CH2Cl 满足同系物条件:二者分子中都含有1个Cl原子,分子之间相差1个CH2基团,
故选C.
点评 本题考查了键线式的书写及根据键线式确定分子式和物质的结构简式,难度不大,明确每个碳原子形成4个共价键即可解答.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:1 | C. | 1:5 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
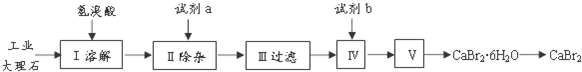
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.
高铁酸钾是一种新型非氯高效消毒剂,常用于工业废水与城市生活污水的处理.某小组同学为研究高铁酸钾对水溶液中苯酚的降解反应速率,在恒定实验温度298K或318K条件下(其余实验条件见下表),设计如下对比实验.| 实验编号 | pH | 投料比(高铁酸钾与苯酚的质量比) | T/K | Fe3+ | 实验目的 |
| Ⅰ | 4 | 10:1 | 298 | 0 | 参照实验 |
| Ⅱ | 4 | 8:1 | 298 | 0 | |
| Ⅲ | 探究温度对该降解反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
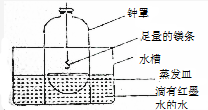 某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究.
某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70.5% | B. | 20% | C. | 29.5% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| B. | 向碳酸氢钡溶液中加入少许氢氧化钠:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 向次氯酸钙溶液中通入过量的二氧化硫气体:SO2+H2O+ClO-═HSO${\;}_{3}^{-}$+HClO | |
| D. | 向复盐(NH4)2Fe(SO4)2溶液中加少许Ba(OH)2:SO${\;}_{4}^{2-}$+2NH${\;}_{4}^{+}$+Ba2++2OH-═BaSO4↓+2NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 NaCl溶液 | B. | 50mL 2mol•L-1CaCl2溶液 | ||
| C. | 100mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com