
| A. | 正向移动 | B. | 逆向移动 | C. | 达到平衡 | D. | 不一定 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 将氯化铁固体溶于稀盐酸配制FeCl3溶液 | |
| B. | 称取4.0gNaOH,放入100mL容量瓶中,加水稀释,配制1.0mol•L-1的NaOH溶液 | |
| C. | 利用图1装置定量测定H2O2的分解速率 | |
| D. | 如图2所示,关闭弹簧夹检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②⑤ | B. | ②④⑤ | C. | 只有①③ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为将CO和NO转化为无毒物质,某同学设计了如图装置.
为将CO和NO转化为无毒物质,某同学设计了如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba( OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷在O2中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B | |
| B. | 晶体A易溶于CCl4则A一定是分子晶体 | |
| C. | 在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属 | |
| D. | 能量低的状态更稳定,则自然界的物质都以能量最低的状态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| A | 简单氢化物能与其最高价含氧酸反应生成盐 |
| B | 原子最外层电子数是其电子层数的3倍 |
| C | 周期表中非金属性最强的元素 |
| D | 与C位于同主族,且都为短周期元素 |
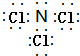 .X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.
.X常用作漂白剂,也用于柠檬等水果的熏蒸处理.已知化合物X中,A显负价,D显正价,则该化合物与水反应的化学方程式为NCl3+4H2O=NH3.H2O+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H5Br | B. | HCOOC2H5 | C. | 蔗糖C12H22O11 | D. | CH3COOCH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| B. | 向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| C. | 向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| D. | 向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com