
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) △H<0。下列结论中正确的是
pC(g)+qD(g) △H<0。下列结论中正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的1.8倍,则m+n<p+q
B.反应达平衡时,A、B的转化率一定相等
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol
D.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
【答案】C
【解析】
A.根据压强对化学平衡移动的影响来分析;
B.当反应物的物质的量之比等于系数值比时,则达到化学平衡时,反应物的转化率是相等的;
C.对于反应前气体体积不变的反应的特点规律来回答;
D.压强不会影响反应前后气体体积不变的反应的平衡移动。
A.将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的1.8倍,说明平衡向正方向移动了,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n>p+q,A错误;
B.反应开始时,若A、B的物质的量之比为m:n,则恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,B错误;
C.若m+n=p+q,则往含有amol气体时建立的平衡和向平衡体系中加入amol的B时建立的平衡等同,所以往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,C正确;
D.若该反应中,m+n=p+q,温度不变时,压强增大到原来的2倍,达到新平衡时,总体积变为原来的![]() ,D错误;
,D错误;
故合理选项是C。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】某天然黄铜矿主要成分为![]() (含
(含![]() ),为测定该黄铜矿的纯度,某同学设计了如下实验:
),为测定该黄铜矿的纯度,某同学设计了如下实验:
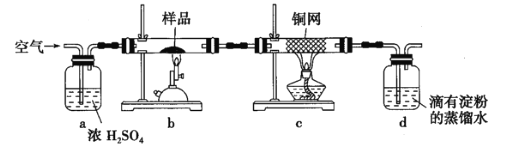
称取硏细的黄铜矿样品![]() 煅烧,生成
煅烧,生成![]() 、
、![]() 、
、![]() 和
和![]() 气体,实验后取
气体,实验后取![]() 中溶液的1/10置于锥形瓶中,用
中溶液的1/10置于锥形瓶中,用![]() 标准碘溶液进行滴定,初读数为
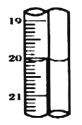
标准碘溶液进行滴定,初读数为![]() ,末读数如图所示,完成下列填空:
,末读数如图所示,完成下列填空:
(1)实验中称量样品所需定量仪器为____________。
(2)装置![]() 的作用是____________。
的作用是____________。
(3)上述反应结束后,仍需通一段时间的空气,其目的是____________。
(4)滴定时,标准碘溶液所耗体积为______![]() 。用化学方程式表示滴定的原理:____________。
。用化学方程式表示滴定的原理:____________。
(5)计算该黄铜矿的纯度____________。
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含![]() ,
,![]() ,
,![]() ,
,![]() )可制备
)可制备![]() 。选用提供的试剂:稀盐酸、稀硫酸、
。选用提供的试剂:稀盐酸、稀硫酸、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,设计实验验证炉渣中含有
溶液,设计实验验证炉渣中含有![]() 。所选试剂为____________,证明炉渣中含有
。所选试剂为____________,证明炉渣中含有![]() 的实验方案为____________。
的实验方案为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,以MnO2为原料制得的MnCl2溶液中常合有Cu2+、Pb2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-→CuS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )

A. 元素Y和元素Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C. 元素Y和元素Z的氢化物中均只存在极性共价键
D. 元素W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)③、④、⑧的原子半径由大到小的顺序为:______(用元素符号回答)。
(2)⑤、⑥、⑦的最高价氧化物对应的水化物碱性由强到弱的顺序是:______。(用化学式回答)
(3)②和⑨两种元素成的某化合物是一种常见的有机溶剂,则该化合物的电子式为:______ 。
(4)④和⑧形成的化合物属于______晶体(填“离子”、“分子”、“原子”),该晶体中微粒间的作用力为:______。
(5)②形成的单质与③形成的最高价氧化物的水化物的浓溶液发生化学反应的方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中提供的数据,下列判断正确的是

A.同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3
B.结合H+的能力:ClO->CO32->F-
C.次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+H2O+CO2=HClO+HCO3-
D.碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF=2F-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是(阿伏伽德罗常数为NA)( )
A.氯气跟水反应的离子方程式:Cl2+H2O=2H++Cl-+ClO-
B.15.6克Na2O2中所含的离子总数为0.3NA
C.11克D218O中含有的中子为6NA
D.![]() 和
和![]() 质子数相同,但属于不同种核素
质子数相同,但属于不同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: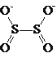 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)

(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com