
| A、7.8g Na2O2所含的阴离子数目为2NA |
| B、在熔融状态下,lmol KHSO4完全电离出的阳离子数目为2NA |
| C、14g乙烯和丙烯的混和气体中共含有3NA对共用电子对 |
| D、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、一定条件下,使用催化剂能加快反应速率但不能改变平衡转化率 | ||
| B、氢氧燃料电池的能量转换形式仅为化学能转化为电能 | ||
| C、在NH4HSO4溶液中由于NH4+的水解促进了水的电离,所以水的电离程度增大 | ||
D、在一密闭容器中发生2SO2+O2?2SO3反应,增大压强,平衡会正向移动,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、32g O2中所含氧原子数为NA个 |
| C、1mol氧约含6.02×1023个O2 |
| D、摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
A、根据②推知反应:CH3OH(l)+
| ||
| B、①反应中,反应物的总能量高于生成物总能量 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、反应②中的能量变化如图所示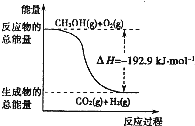 |
查看答案和解析>>
科目:高中化学 来源: 题型:
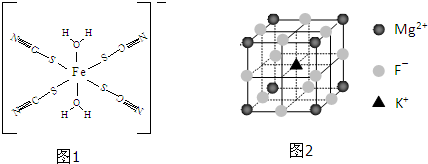
查看答案和解析>>
科目:高中化学 来源: 题型:
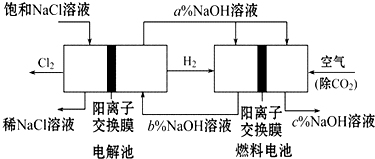
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com