
【题目】常温下,Ka1 (H2SO3)=1.5×10-2,Ka2=1.0×10-7,Kb (NH3·H2O) =1.76×10-5,设H2SO3溶液中c(总)=c(![]() )+c(
)+c(![]() )+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
)+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
A.溶液中始终存在:c(![]() )+c(H+ )=c(
)+c(H+ )=c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
B.在NH4HSO3溶液中:c(![]() )>c(
)>c(![]() )>c(NH3·H2O)>c(H2SO3)
)>c(NH3·H2O)>c(H2SO3)
C.pH=7的溶液:c(![]() )=2c(
)=2c(![]() )+c(
)+c(![]() )
)
D.c(![]() )=2c(总)的溶液中:c(NH3·H2O)+c(OH)=c(H+ )+c(
)=2c(总)的溶液中:c(NH3·H2O)+c(OH)=c(H+ )+c(![]() )+2c(H2SO3)
)+2c(H2SO3)
【答案】CD
【解析】
A.溶液中始终存在电荷守恒:c(![]() )+c(H+ )=2c(
)+c(H+ )=2c(![]() )+c(
)+c(![]() )+c(OH),A错误;
)+c(OH),A错误;
B.常温下,NH4+的水解常数K1=![]() ≈5.7×10-10,HSO3-的水解常数K2=
≈5.7×10-10,HSO3-的水解常数K2=![]() ≈6.7×10-13,HSO3-的电离常数Ka2=1.0×10-7,Ka2>K1>K2,所以c(
≈6.7×10-13,HSO3-的电离常数Ka2=1.0×10-7,Ka2>K1>K2,所以c(![]() )>c(
)>c(![]() ),c(NH3·H2O)>c(H2SO3),故c(
),c(NH3·H2O)>c(H2SO3),故c(![]() )>c(
)>c(![]() )>c(NH3·H2O)>c(H2SO3),B错误;
)>c(NH3·H2O)>c(H2SO3),B错误;
C.电荷守恒:c(![]() )+c(H+ )=2c(
)+c(H+ )=2c(![]() )+c(
)+c(![]() )+c(OH),pH=7的溶液:c(H+ )=c(OH),所以c(
)+c(OH),pH=7的溶液:c(H+ )=c(OH),所以c(![]() )=2c(
)=2c(![]() )+c(
)+c(![]() ),C正确;
),C正确;
D.c(![]() )=2c(总)=2[c(
)=2c(总)=2[c(![]() )+c(
)+c(![]() )+c(H2SO3)],则该溶液为(NH4)2SO3,该溶液的质子守恒为:c(NH3·H2O)+c(OH)=c(H+ )+c(
)+c(H2SO3)],则该溶液为(NH4)2SO3,该溶液的质子守恒为:c(NH3·H2O)+c(OH)=c(H+ )+c(![]() )+2c(H2SO3),D正确。
)+2c(H2SO3),D正确。
答案选CD。


科目:高中化学 来源: 题型:
【题目】下列实验中,实验操作、装置、现象及结论都正确的是
选项 | 实验操作或装置 | 实验现象 | 相关解释及结论 |
A. | 用两支试管各取5 mL 0.1 mol·L-1酸性KMnO4溶液,分别加入2 mL 0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液 | 两试管溶液均褪色,且加0.2 mol·L-1H2C2O4的试管中褪色更快 | 其他条件不变,H2C2O4浓度越大,化学反应速率越大 |
B. |
| 左球气体颜色加深,右球气体颜色变浅 | 勒夏特列原理 |
C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
D. |
| 饱和Na2CO3溶液上有透明的不溶于水的油状液体产生 | 乙酸乙酯难溶于水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、科技关系密切,下列说法中正确的是( )
A.“碳海绵”吸收泄漏的原油时发生了化学变化
B.“玉兔二号”月球车首次实现在月球背面着陆,其帆板太阳能电池的材料是二氧化硅
C.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
D.氢燃料电池中使用的储氢材料,如稀土类![]() 等合金材料是纯净物
等合金材料是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
请回答钢铁在腐蚀、防护过程中的有关问题。

(1)下列哪些装置不能防止铁棒被腐蚀________________;
(2)实际生产可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图.请回答:

①B电极对应的金属是________(写元素名称),
A电极的电极反应式是___________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象和结论或原因相符![]() 是( )
是( )
操作及现象 | 原因或结论 | |
A | 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落 | 铝的熔点高于三氧化二铝 |
B | 某溶液中先加入稀盐酸,再加入加入硝酸银产生白色沉淀 | 原溶液中一定含有Cl- |
C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
D | 向氢氧化钠溶液中加入适量硫酸亚铁溶液,白色沉淀迅速变成灰绿色,最后变成红褐色 | 生成的氢氧化亚铁沉淀不稳定,容易被氧气氧化成氢氧化铁 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性条件下使用鸟粪石[Mgx(NH4)y(PO4)z·nH2O]处理氨氮废水具有加热时间短,氨逸出彻底等优点。反应原理如下:
yNa++yOH-+Mgx(NH4)y(PO4)z·nH2O![]() Mgx(Na)y(PO4)z+yNH3↑+(n+y)H2O
Mgx(Na)y(PO4)z+yNH3↑+(n+y)H2O
Mgx(Na)y(PO4)z+y![]() +nH2O
+nH2O![]() yNa++Mgx(NH4)y(PO4)z·nH2O↓
yNa++Mgx(NH4)y(PO4)z·nH2O↓
(1)上述氨氮废水处理过程中鸟粪石所起的作用是__________。
(2)其它条件不变,若鸟粪石化学式中的z保持不变,x越大,处理相同量的氨氮废水所需的时间就_________(填:“越长”“越短”“不变”)。
(3)为测定鸟粪石的组成,进行下列实验:
①取鸟粪石2.45 g与足量的NaOH溶液混合,加热,收集到标准状况下的气体224mL
②另取鸟粪石2.45 g溶于稍过量盐酸,用蒸馏水配成100.00 mL溶液A;
③取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+,滴定至终点,消耗EDTA标准溶液25 mL(已知Mg2+与EDTA反应的化学计量比1∶1);
④取25.00 mL溶液A,加入0.005mol的BiCl3,调节溶液pH生成Mg3(PO4)2和BiPO4沉淀,过滤,滤液中的Bi3+用EDTA标准溶液滴定为![]() mol。通过计算确定鸟粪石的化学式_____________(写出计算过程)。
mol。通过计算确定鸟粪石的化学式_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为_____________。
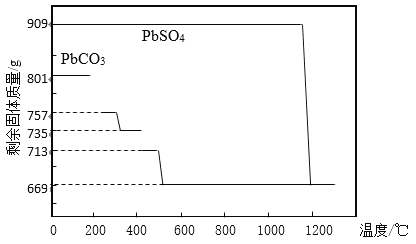
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是_____________。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中![]() 浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
②随温度升高和![]() 浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。

(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式:__________。
②采用脉冲电解比普通电源电解的优点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CrCl3·6H2O是中学化学中的常见物质,工业上用铬酸钠(Na2CrO4)来制备。某兴趣小组以实验室中的红矾钠(Na2Cr2O7)为原料来制备CrCl3·6H2O。流程如下:

已知:
a.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇、易水解。
b.CrCl3·6H2O易升华,在高温下能被氧化。
(1)步骤Ⅰ中加入40%NaOH的目的是__________________________。步骤1中甲醇作为还原剂,反应后生成CO2,请写出反应的离子方程式_________________________。
(2)步骤Ⅲ,请补充完整由步骤Ⅱ得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:
ⅰ:将过滤后所得固体溶解于过量的盐酸中,ⅱ: ,ⅲ:过滤,ⅳ:洗涤,ⅴ:干燥,得到CrCl3·6H2O。
①操作ⅱ为_________________________________。
②操作ⅳ最合适的洗涤剂是_____________。
A.乙醇 B.乙醚 C.冷水
③操作ⅴ应选择的干燥方式为_____________。
(3)样品中三氯化铬质量分数的测定
称取样品,加水溶解并定容于容量瓶中。移取一定体积溶液于碘量瓶(一种带塞的锥形瓶)中,加入Na2O2,在一定条件下充分反应后,适当稀释,然后加入过量的稀H2SO4至溶液呈强酸性,此时铬以![]() 存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
①充分加热煮沸的原因是 _______________________。
②在使用硫代硫酸钠溶液滴定过程中使用到碱式滴定管,选出其正确操作并按顺序列出字母:蒸馏水洗涤→加入待量液3~5mL→_____→_____→_____→_____→_____→滴定,进行实验。
a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm
e.将滴定管尖端对准锥形瓶,且置于锥形瓶口上方约1cm处
f.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
g.橡皮管向上弯曲,挤压玻璃球,放液
③下图是碱式滴定管的内部构造,滴定时,左手应该捏住乳胶管中玻璃球的______部位(填“a”、“b”或“c”),挤捏乳胶管,使其与玻璃球之间形成一条缝隙,溶液即可流出。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com