
·ÖĪö £Ø1£©Ļ”ŹĶ¹ż³ĢÖŠĮņĖįµÄĪļÖŹµÄĮæ²»±ä£¬µ±ČÜŅŗ½Ó½üÖŠŠŌŹ±ŅŖæ¼ĀĒĖ®µÄµēĄė£¬ĖłŅŌ½«pH=5µÄĮņĖįČÜŅŗĻ”ŹĶ500±¶ŗó£¬ČÜŅŗÖŠµÄSO42-ÓėH+ÅØ¶ČµÄ±ČÖµŌ¼ĪŖ1£ŗ10£»
£Ø2£©25”ꏱ£¬Kw=10-14£¬Ä³ĒæĖįČÜŅŗpH=a£¬ŌņøĆĖįČÜŅŗÖŠĒāĄė×ÓÅضČĪŖ10-a mol/L£¬Ēæ¼īČÜŅŗpH=b£¬Ōņ¼īČÜŅŗÖŠĒāŃõøłĄė×ÓÅضČ=10 b-14 mol/L£¬ČÜŅŗ³ŹÖŠŠŌĖµĆ÷ĒāĄė×ÓŗĶĒāŃõøłĄė×ÓµÄĪļÖŹµÄĮæĻąµČ£»
£Ø3£©pH=3µÄŃĪĖįÖŠĖ®µēĄėµÄH+µÄÅضČŗĶĖ®µēĄė³öĒāŃõĄė×ÓÅضČĻąµČ£»
£Ø4£©øł¾ŻČÜŅŗµÄpH¼ĘĖćČÜŅŗÖŠĒāĄė×ÓÅØ¶Č£¬øł¾ŻĒāŃõ»ÆÄʵÄÅØ¶Č¼ĘĖćĒāŃõøłĄė×ÓÅØ¶Č£¬ŌŁ½įŗĻKw=c£ØH+£©£®c£ØOH-£©¼ĘĖć£»øł¾Żc£ØOH-£©=$\frac{Kw}{C£Ø{H}^{+}£©}$¼ĘĖć$\frac{C£Ø{H}^{+}£©}{C£ØO{H}^{-}£©}$Öµ£»
£Ø5£©øł¾Ż“æĖ®ÖŠc£ØOH-£©=c£ØH+£©£¬ČÜŅŗĻŌŹ¾ÖŠŠŌ½ųŠŠ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©pHĪŖ5µÄČÜŅŗÖŠĒāĄė×ÓÅضČĪŖ£ŗc£ØH+£©=1”Į10-5mol/L£¬ĮņĖįøłĄė×ÓµÄÅضČĪŖ£ŗc£ØSO42-£©=5”Į10-6mol/L£¬
ČÜŅŗĻ”ŹĶ500±¶ŗó£¬ĒāĄė×ÓÅØ¶Č²»æÉÄÜŠ”ÓŚ1”Į10-7mol/L£¬Ö»ÄÜĪŽĻŽ½Ó½ü1”Į10-7mol/L£¬¶ųĮņĖįøłĄė×ÓÅضČĪŖ£ŗc£ØSO42-£©=1”Į10-8mol/L£¬
ĖłŅŌĻ”ŹĶŗóČÜŅŗÖŠĮņĖįøłĄė×ÓÓėĒāĄė×ÓÅضČÖ®±ČĪŖ£ŗ1”Į10-8mol/L£ŗ1”Į10-7mol/L=1£ŗ10£¬
¹Ź“š°øĪŖ£ŗ1£ŗ10£»
£Ø2£©25”ꏱ£¬Kw=10-14£¬Ä³ĒæĖįČÜŅŗpH=a£¬ŌņøĆĖįČÜŅŗÖŠĒāĄė×ÓÅضČĪŖ10-a mol/L£¬Ēæ¼īČÜŅŗpH=b£¬Ōņ¼īČÜŅŗÖŠĒāŃõøłĄė×ÓÅضČ=10 b-14 mol/L£¬ČÜŅŗ³ŹÖŠŠŌĖµĆ÷ĒāĄė×ÓŗĶĒāŃõøłĄė×ÓµÄĪļÖŹµÄĮæĻąµČ£¬ÉčĖįµÄĢå»żĪŖV£ØĖį£©£¬¼īµÄĢå»żĪŖV£Ø¼ī£©£¬10-a mol/L”ĮV£ØĖį£©L=10 b-14 mol/L”ĮV£Ø¼ī£©L£¬ŌņV1=10 a+b-14 V£Ø¼ī£©£¬¶ųa+b=12£¬¹ŹV£Ø¼ī£©=100V£ØĖį£©£¬
¹Ź“š°øĪŖ£ŗV£Ø¼ī£©=100V£ØĖį£©£»
£Ø3£©pH=3µÄŃĪĖįÖŠĒāŃõøłĄė×ÓĄ“×ŌÓŚĖ®µÄµēĄė£¬c£ØOH-£©=$\frac{Kw}{C£Ø{H}^{+}£©}$=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L£¬¶ųČÜŅŗÖŠĖ®µēĄėµÄH+µÄÅضČŗĶĖ®µēĄė³öĒāŃõĄė×ÓÅضČĻąµČ£¬
¹Ź“š°øĪŖ£ŗ10-11£»
£Ø4£©0.01mol•L-1µÄNaOHČÜŅŗµÄpHĪŖ11£¬ŌņĒāĄė×ÓÅضČ=10-11 mol/L£¬ĒāŃõ»ÆÄĘŹĒĒæµē½āÖŹĶźČ«µēĄė£¬ĖłŅŌČÜŅŗÖŠĒāŃõøłĄė×ÓÅØ¶ČŹĒ0.01mol/L£¬ŌņKw=c£ØH+£©£®c£ØOH-£©=0.01”Į10-11=10-13£¬
øĆĪĀ¶ČĻĀKw=10-13£®pH=3ČÜŅŗÖŠC£ØH+£©=10-3mol•L-1£¬c£ØOH-£©=$\frac{Kw}{C£Ø{H}^{+}£©}$=$\frac{1{0}^{-13}}{1{0}^{-3}}$=10-10mol/L£¬ĖłŅŌ$\frac{C£Ø{H}^{+}£©}{C£ØO{H}^{-}£©}$=107£¬
¹Ź“š°øĪŖ£ŗ10-13£Ømol/L£©2£»107£»
£Ø5£©“æĖ®ĻŌŹ¾ÖŠŠŌ£¬c£ØOH-£©=c£ØH+£©=5.0”Į10-7mol/L£¬¹Ź“š°øĪŖ£ŗ5.0”Į10-7mol/L£®
µćĘĄ ±¾Ģāæ¼²éĮĖĄė×Ó»ż³£ŹżµÄÓŠ¹Ų¼ĘĖć£¬øł¾ŻČÜŅŗµÄĖį¼īŠŌ¼°Ė®µÄĄė×Ó»ż³£ŹżĄ“·ÖĪö½ā“š£¬×¢ŅāÕĘĪÕČÜŅŗÖŠĒāĄė×Ó”¢ĒāŃõøłĄė×ÓÅضČÓėČÜŅŗpHµÄ¹ŲĻµ£¬×¢ŅāĖ®µÄĄė×Ó»ż³£ŹżÓėĪČ¶ØµÄ¹ŲĻµĪŖŅדķµć£¬ĢāÄæÄѶČÖŠµČ£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
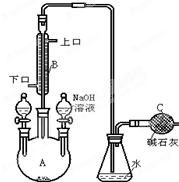 ÖʱøŅ»äåŅģ±ū±½µÄŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£¬ĻĀĮŠ²Ł×÷ÕżČ·µÄŹĒ£Ø””””£©
ÖʱøŅ»äåŅģ±ū±½µÄŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£¬ĻĀĮŠ²Ł×÷ÕżČ·µÄŹĒ£Ø””””£©| A£® | ×°ŌŚ×ó²ą·ÖŅŗĀ©¶·ÖŠµÄŅ©Ę·ŹĒ±½ŗĶŅŗäå | |
| B£® | ÓŅ²ą·ÖŅŗĀ©¶·ÖŠµÄĪļÖŹµÄ×÷ÓĆŹĒ“߻ƼĮ | |
| C£® | æÉĻņ׶ŠĪĘæÖŠ¼ÓČėĻõĖįĖį»ÆµÄAgNO3ČÜŅŗ£¬ÓŠµ»ĘÉ«³Įµķ²śÉś£¬ĖµĆ÷“Ė·“Ó¦ĪŖČ”“ś·“Ó¦ | |
| D£® | æÉŌŚBÓė׶ŠĪĘæÖ®¼äĮ¬½ÓŅ»øö ×°ÖĆ²¢¼ÓČėCCl4ŅŗĢåĄ“³żČ„HBrÖŠäåÕōĘų ×°ÖĆ²¢¼ÓČėCCl4ŅŗĢåĄ“³żČ„HBrÖŠäåÕōĘų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĶØČėĖ®ÖŠ | B£® | ĶØČė³ĪĒåŹÆ»ŅĖ®ÖŠ | ||
| C£® | ĶØČėäåĖ® | D£® | »ģČėĒāĘų½ųŠŠ¹āÕÕ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗ¬ÓŠNAøöµŖŌ×ӵĵŖĘųŌŚ±ź×¼×“æöĻĀµÄĢå»żŌ¼ĪŖ11.2L | |
| B£® | 25”ę£¬1.01”Į105Pa£¬64gSO2ÖŠŗ¬ÓŠµÄŌ×ÓŹżŠ”ÓŚ3NA | |
| C£® | ŌŚ³£ĪĀ³£Ń¹ĻĀ£¬11.2L Cl2ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA | |
| D£® | 1 mo1 Na2O2Óė×ćĮæH2O·“Ó¦£¬×ŖŅĘĮĖ2 NA øöµē×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ | B£® | x+y£¾z | ||
| C£® | BµÄ×Ŗ»ÆĀŹĢįøß | D£® | CµÄĢå»ż·ÖŹżŌö¼Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1mol/LH2SO4Óė0.2mol/L °±Ė®ø÷50mL | |
| B£® | 0.1mol/LCH3COOHÓė0.1mol/LNaOH ČÜŅŗø÷50mL | |
| C£® | pH=1µÄCH3COOHÓėpH=13µÄ NaOH ČÜŅŗø÷50mL | |
| D£® | pH=1µÄŃĪĖįÓė pH=13µÄ NaOH ČÜŅŗø÷50mL |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ľ²ÄĻĖĪ¬ŗĶĶĮ¶¹µķ·ŪÓöµāĖ®¾łĻŌĄ¶É« | |
| B£® | Ź³ÓĆ»ØÉśÓĶŗĶ¼¦µ°Ē嶼ÄÜ·¢ÉśĖ®½ā·“Ó¦ | |
| C£® | °ü×°ÓĆ²ÄĮĻ¾ŪŅŅĻ©ŗĶ¾ŪĀČŅŅĻ©¶¼ŹōÓŚĢž | |
| D£® | PXĻīÄæµÄÖ÷ŅŖ²śĘ·¶Ō¶ž¼×±½ŹōÓŚ±„ŗĶĢž |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com