
(11分) 硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
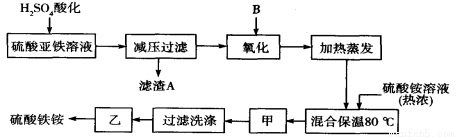
请回答下列问题:
(1)操作甲、乙的名称分别是:甲______________,乙___________________。
(2)下列物质中最适合的氧化剂B是 ;使用过程中分多次添加适量的氧化剂原因是
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)上述流程中,用足量最适合的氧化剂B氧化之后和加热蒸发之前,需取少量检验Fe2+是否已全部被氧化,所加试剂为 (写名称)。能否用酸性的KMnO4溶液?理由是: 。(可用文字或方程式说明)
(4)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为________________(写出计算过程)
共11分
(1)冷却结晶(1分,结晶无分);常温晾干(1分,干燥无分)
(2)b(1分);反应放热,使未反应的H2O2分解,造成浪费(2分)
(3)铁氰化钾溶液(1分) 不能,因为过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色(2分)
(4)(共3分)加入氢氧化钠得到2.14 g沉淀为氢氧化铁,所以n(Fe)= ;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀,因此n(SO42-)= 0.05 mol ;(1分)
;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应生成硫酸钡沉淀,因此n(SO42-)= 0.05 mol ;(1分)
所以Fe2(SO4)3为0.01 mol,(NH4)2SO4为0.02 mol ,此时质量为:0.01 mol ×400g/mol+0.02 mol ×132g/mol=6.64g,(1分)
每一份溶液中水的质量为:7.00g-6.64g=0.36g,n(H2O)=0.02 mol,因此该硫酸铁铵的化学式为:Fe2(SO4)3·2(NH4)2SO4·2H2O(1分)
【解析】
试题分析:原料中加入硫酸酸化,可生成硫酸钙沉淀,减压过滤后加入过氧化氢氧化可生成硫酸铁,加入硫酸铵,在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵。
(1)在80℃下反应可生成硫酸铁铵,经蒸发浓缩、冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,温度不能过高,防止分解。
(2)如果使用NaClO、KMnO4、K2Cr2O7做氧化剂,所得还原产物为杂质,如果H2O2做氧化剂,还原产物为H2O,不产生新的杂质,故b项正确;该氧化还原反应为放热反应,如果一次加入过多的H2O2,反应放热,使未反应的H2O2分解,造成浪费。
(3)铁氰化钾与Fe2+反应生成蓝色沉淀,所以使用铁氰化钾溶液检验Fe2+;KMnO4为强氧化剂,不仅能氧化Fe2+,还能氧化H2O2,所以过氧化氢和二价铁离子均能使酸性高锰酸钾溶液褪色,故不能使用酸性KMnO4,。
(4)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,n(Fe(OH)3)=2.14g÷107g/mol=0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,n(H2O)=0.72g÷18g/mol=0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3?2(NH4)2SO4?2H2O。
考点:本题考查化学流程的分析、物质的分离、提纯制备


科目:高中化学 来源:2015届湖北黄冈蕲春县第一高级中学高二下期中考试化学卷(解析版) 题型:选择题
根据有机化合物的命名原则,下列命名正确的是( )
A.CH3CH=C(CH3) CH3 3-甲基-2-丁烯
B.CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷
C. CH3CH(OH)CH2CH3 2-羟基丁醇
D.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三十月阶段性考试化学试卷(解析版) 题型:选择题
据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是
A.在此反应中,每生成1molO2(PtF6),则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价
D.O2(PtF6)中仅存在离子键不存在共价键
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中能大量共存的是( )
A.滴入甲基橙显红色的溶液中:NH4+、Ba2+、AlO2-、Cl-
B.pH=13的溶液:Na+、K+、SiO32-、HCO3-
C.含较多的SO32-的溶液:H+、Ca2+、Fe3+、NO3-
D.澄清透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列判断不合理的是( )
A.能电离出H+的物质一定是酸
B.焰色反应是物理变化
C.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D.蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
甲、乙两个电解池均以Pt为电极且互相串联。甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池阴极质量增加2.16g,乙池电极析出0.24g金属,则乙池中溶质可能是
A.CuSO4 B.MgSO4 C.Al(NO3)3 D.Na2SO4
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
一定条件下,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1。现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热ΔH如表所示:
2SO3(g) ΔH=-197 kJ·mol-1。现有容积固定且相同的五个容器,在上述条件下分别充入的气体和反应热ΔH如表所示:

根据以上数据,下列选项正确的是
A.ΔH1=2ΔH2 B.ΔH3<ΔH4 C.ΔH1+ΔH5=197 D.ΔH2=ΔH3
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
在容积固定为4L的密闭容器中,进行了可逆反应:X(g)+2Y(g)  2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示
2Z(g) 并达到平衡,在此过程中Y的速率V(Y)与时间t的关系,如图所示,则图中阴影部分的面积可表示

A.X浓度的减少
B.X物质的量的减少
C.Z浓度的增加
D.Y物质的量的减少
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写不正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+= BaSO4↓+ NH3?H2O+H2O
B.将少量SO2气体通入NaClO溶液中:SO2+H2O+ ClO-=SO42-+Cl-+2H+
C.硫化钠的水解:S2-+ H2O H S- + OH-
H S- + OH-
D.NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com