
【题目】下列说法正确的是
A.“液氯”因其具有强氧化性不能用钢瓶运输
B.氧化镁具有较高的熔点,常被用于耐高温材料
C.在医疗上,纯碱可用于治疗胃酸过多,但不能用于胃穿孔病人
D.硅是一种重要的半导体材料,常被用于制造光导纤维
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下列关于液氯和氯水的叙述中正确的是( )
A、液氯是纯净物,而氯水是混合物 B、液氯无酸性,氯水有酸性
C、液氯和氯水都有漂白性 D、液氯无色,氯水呈黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Na+、CH3COO﹣、Br﹣
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO ![]() 、Cl﹣
、Cl﹣
C.0.1 molL﹣1 FeCl3溶液:K+、NH![]() 、I﹣、SCN﹣
、I﹣、SCN﹣
D.由水电离的c (H+)=1×10﹣14 molL﹣1的溶液中:Ca2+、K+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂: A.饱和食盐水 B.NaOH溶液
请在以上试剂中选择填空(填“A”或“B”):
①写出上述制取氯气的离子方程式_____________________,X溶液应选用______。
②尾气处理过程中,多余的氯气可用______吸收,写出该过程的离子方程式_____。

(2)FeSO47H2O受热分解的化学方程式为:2FeSO47H2O ![]() Fe2O3+SO2↑+SO3↑+14 H2O
Fe2O3+SO2↑+SO3↑+14 H2O
请回答:
① FeSO47H2O俗名叫________矾,将其受热产生的气体按图示装置进行实验,证实含有SO3和SO2。 能说明SO2存在的实验现象是________;为测定BaSO4沉淀的质量,后续的操作步骤依次为________、洗涤、干燥、称重。
②设计一个实验方案,用化学方法验证FeSO4受热后固体的成分(不考虑其他反应)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料.
(1)制取氢气
已知:CH4(g)+H2O(g)CO(g)+3H2(g)△H=+206.2kJmol﹣1
CH4(g)+CO2(g)2CO(g)+2H2(g)△H=+247.4kJmol﹣1
(i)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
(ii)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:
CH4(g)+H2O(g)CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率
②该反应的化学平衡常数;
③图中的p1p2(填“<”、“>”或“=”);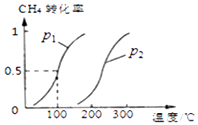
(2)制备甲醇
在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0.若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.再充入1mol CO和3mol H2
C.将CH3OH(g)从体系中分离
D.充入He,使体系总压强增大
E.使用更高效的催化剂
(3)合成乙酸
甲烷直接合成乙酸具有重要的理论意义和应用价值.光催化反应技术使用CH4和(填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100%).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知浓度的硫酸溶液20mL,在加入0.2 mol·L-1 Ba(NO3)2溶液15 mL后,改加NaOH溶液,结果用去0.1mol·L-1 NaOH溶液100 mL恰好完全中和,则硫酸的物质的量浓度是
A. 0.5 mol·L-1 B. 1.0 mol·L-1 C. 0.2 mol·L-1 D. 0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)坩埚是实验室用于灼烧或熔融固体物质的常用仪器,熔融烧碱,可以使用_______。
(2)写出铜与浓硫酸反应的化学方程式:____________________________。
(3)漂白粉的有效成分是 ____________________ 。
(4)玻璃中含有SiO2,所以可以用______________来刻蚀玻璃。
(5)钠常常保存在___________________中。
(6)酸雨有很大的危害,能直接破坏农作物,森林,草原等,请用化学方程式写出SO2形成硫酸型酸雨的过程:________________________ ,________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com