
【题目】如图是我国科学家研制的一种新型化学电池,成功实现了废气的处理和能源的利用(H2R和R都是有机物)。下列说法不正确的是( )
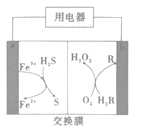
A.电池工作时,电子从电极b流出
B.负极区,发生反应2Fe3++H2S=2Fe2++S+2H+
C.电池工作时,负极区要保持呈酸性
D.电路中每通过2mol电子,理论上可处理标准状况下H2S22.4L
【答案】A
【解析】
根据图示,a电极生成Fe3+,生成Fe3+和H2S生成S和Fe2+,Fe2+在电极a处失去电子生成Fe3+,电极反应为Fe2+-e-=Fe3+,生成的Fe3+能够继续氧化H2S;b电极一侧,O2和H2R反应生成H2O2和R,R在电极b处得到电子和H+生成H2R,电极方程式为R+2e-+2H+=H2R,可知,电极a为负极,电极b为正极。
A.电池工作时,电子从负极流出,a为负极,电子从电极a流出,A错误,符合题意;
B.根据图示,负极区,Fe3+和H2S反应生成Fe2+和S,离子方程式为2Fe3++H2S=2Fe2++S+2H+,B正确,不选;
C.电池工作时,Fe3+与H2S反应,存在Fe3+的溶液为酸性,因此负极区需要保持酸性,防止Fe3+水解沉淀,C正确,不选;
D.根据电极反应,每通过2mol电子,能够生成2molFe3+,2molFe3+能够氧化1molH2S,则处理标准状况下H2S的体积为22.4L,D正确,不选。
答案选A。


科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是( )

A.用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
B.利用装置③可制备氢氧化亚铁并长时间观察其颜色
C.装置④不能验证Na2CO3和NaHCO3两种固体的热稳定性
D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑。
A+N2↑+3CO2↑。
①除S外,上列元素的电负性从大到小依次为____。
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为____,Q2+的未成对电子数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)在皮革、火柴印染化学、电镀等方面应用广泛。工业上对制革工业污泥中(主要含有Cr3+、Fe3+、Fe2+、Al3+等)Cr元素的回收与再利用工艺如图:

已知:①Al(OH)3与Cr(OH)3性质相似。
②2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
③有关物质的溶解度曲线如图。
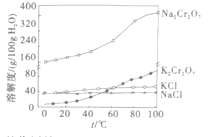
回答下列问题:
(1)含铬污泥预处理包括高温煅烧粉碎等步骤,其中高温煅烧的目的是__(写一条即可),滤渣III的成分是__(填化学式)。
(2)步骤③中操作需要的玻璃仪器有__,步骤①加入H2O2的作用是__。
(3)步骤⑦反应能够发生的原因是__,写出步骤④的反应离子方程式:__。
(4)为测定产品中K2Cr2O7的含量,某兴趣小组将mg产品溶于水配制为500mL溶液,准确量取50.00mL,加入稀硫酸酸化,然后加入过量的KI充分还原,加___作指示剂,到达终点消耗30.00mL0.0500mol·L-1的Na2S2O3溶液。则该次生产的样品中K2Cr2O7含量为__%。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃在工业生产中有着重要的用途。下列有关苯乙烯和2-苯基丙烯(![]() )的说法错误的是( )
)的说法错误的是( )
A.二者互为同系物
B.均能使澳水溶液褪色
C.分子中的所有原子均可能在同平面上
D.均能发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+] |
B.[Na+]=[Cl-]>[H+]>[OH-] |
C.[Na+]=[Cl-]>[OH-]>[H+] |
D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1______C2(填“<”、“=”或“>”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe,M=204g/mol]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某化学实验小组利用FeCO3与甘氨酸反应制备甘氨酸亚铁,实验过程如下:
已知:①甘氨酸亚铁易溶于水,难溶于酒精。②甘氨酸具有两性,易溶于水,微溶于酒精:柠檬酸易溶于水和酒精,具有强酸性和强还原性。
I.制备FeCO3:
实验小组将足量的废铁屑和500mL1.0mol·L-1稀硫酸反应,再与200mL1.0mol·L-1NH4HCO3溶液充分混合,装置如图,反应结束后过滤并洗涤沉淀。
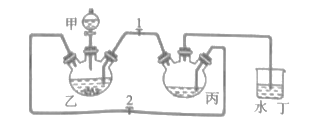
(1)仪器甲的名称为__。
(2)丙中发生反应的离子方程式为__。
(3)实验时先打开止水夹2,关闭止水夹1,加入药品,塞上塞子,待丁中产生大量气泡后,关闭止水夹2,打开止水夹1,观察到的现象为__。
II.制备(NH3CH2COO)2Fe:
将步骤I得到的沉淀全部转移到仪器B,同时加入200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。通入氮气,通过A向B中加入适量氢氧化钠溶液调节pH为6,充分反应。
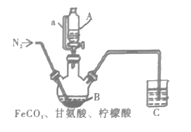
(4)仪器a的作用是__。
(5)实验过程前通入氮气的目的是__,C的导管插入液面下的作用是__。
(6)柠檬酸的作用是__。
(7)反应结束后,将B中液体蒸发浓缩,加入___(填试剂名称),过滤、洗涤并干燥得15.3g甘氨酸亚铁,则其产率是__%(假设上述各步反应均完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)1 mol H2O中约含有________个H2O、________个H、________个O、________mol H、________ mol O。
(2)含有6.02×1023个H的H2O,其物质的量是_______;1 mol Na2SO4溶于水能电离出________个Na+、________个SO42-。
(3)________mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(4)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(5)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(6)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(7)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n=________。
(8)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )
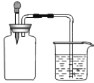
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①②B.②C.③④D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com