
【题目】某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。
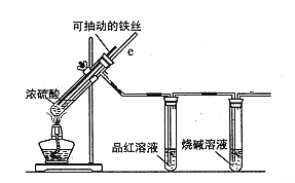
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
【答案】(1)2Fe + 6H2SO4(浓) ![]() Fe2(SO4)3 + 3SO2↑ + 6H2O (2分)
Fe2(SO4)3 + 3SO2↑ + 6H2O (2分)
立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液 (2分)
(2)停止加热时,防止倒吸或平衡压强 (1分)
(3)检验是否生成SO2(1分)
(4)C + 2H2SO4![]() CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
【解析】
试题分析: 铁与浓硫酸在加热的条件下可反应生成硫酸铁、二氧化硫和水,浓硫酸具有强氧化性和腐蚀性,故少量的浓硫酸不慎滴在皮肤上应立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液,若是大量的浓硫酸,应先用干布拭擦,再用大量水冲洗,再涂上3%~5%的NaHCO3溶液。导气管e作用:导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境,停止加热时,防止倒吸或平衡压强。二氧化硫可以使品红溶液褪色,故二氧化硫可以用品红溶液来检查产物是否生成二氧化硫。铁丝是铁碳合金,含有碳,而浓硫酸具有强氧化性,可以与碳反应生成二氧化碳,二氧化硫和水。


科目:高中化学 来源: 题型:
【题目】下表列出了10种元素在元素周期表中的位置:
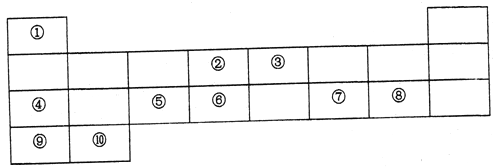
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第_____周期,第______族。
(2)上述10种元素中,金属性最强的元素的符号为_________,最高价氧化物对应水化物中,酸性最强的物质的分子式为______,其中和Ar核外电子排布相同的离子的半径由大到小的顺序是为__________(用离子符号表示)。
(3)元素③的最高价氢化物的电子式为________,元素②和元素⑥的最简单氢化物中,稳定性较强的物质的结构式为______。用电子式表示⑦和⑨形成化合物的过程________。
(4)④在空气中燃烧的产物中所含化学键有________。
A.离子键 B.极性键 C.非极性键
(5)元素④、⑤、⑦的最高价氧化物对应水化物两两之间发生反应的离子方程式分别为____、_______、________。⑧的单质与⑩的最高价氧化物对应水化物反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
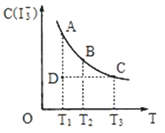
A.I2(aq)+I-(aq)![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度T1,T2的平衡常数分别为K1,K2,则K1<K2
C.反应进行到状态D时,一定有V正>V逆
D.状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题。
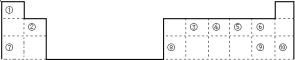
(1)写出下列序号表示的元素的符号:
①_________⑤__________⑧__________。
(2)上述10种元素中,金属元素有_____种。
(3)上述10中元素中,最不活泼的元素是________________(用元素名称表示)。
(4)⑨在周期表中的位置是___________。
(5)实验室制取④的最简单氢化物的化学反应方程式是:___________;单质⑦与水反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4)+分别为a、b、c(单位为mol/L).下列判断正确的是( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温、恒压下,在一个可变容积的容器中发生如下反应:A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,若开始时放入3mol A和3mol B,到达平衡后,生产C的物质的量为__________mol.
(2)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x=__________mol,y=__________mol.平衡时,B的物质的量__________(选填一个编号)
(甲)大于2mol (乙)等于2mol (丙)小于2mol (丁)可能大于、等于或小于2mol
(3)若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是__________.
Ⅱ.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始时放入1molA和1molB到达平衡后生成b molC.将b与(1)小题中的a进行比较正确的是__________(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名烃A:_____________________;

烃A的一氯代物具有不同沸点的产物有________种。
(2)有机物 的系统命名是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
的系统命名是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
(3)有机物 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com