
| 装置 | 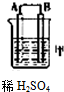 |  | 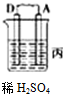 |
| 现象 | 金属A不断溶解 | C极质量增加 | A上有气体产生 |
分析 (1)甲装置中,金属A不断溶解说明A失电子发生氧化反应而作负极,B作正极;乙中C的质量增加,说明C上银离子得电子发生还原反应,则C作原电池正极,B作负极;丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,作原电池负极的金属活动性大于作正极金属;
(2)①原电池是将化学能转变为电能的装置,原电池放电时,电子从负极沿导线流向正极;
②负极上燃料失电子发生还原反应,正极上氧气得电子生成氢氧根离子;
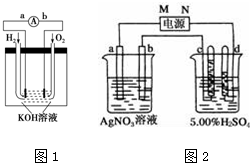
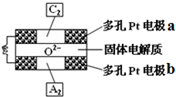
(3)通电一段时间后,发现只有c、d两极上有气体产生,说明溶液中的银离子在b电极上得电子,所以b电极是阴极,则a、c是阳极,d是阴极,M是原电池正极,N是负极,c极生成氧气,d极生成氢气.
①M为电源的正极;
②左边装置中Ag作阳极、Pt作阴极,为电镀池,阳极溶解Ag质量等于阴极析出Ag质量,相当于电解质溶液中硝酸银没有参加反应;电解稀硫酸时,阳极上生成氧气、阴极上生成氢气,相当于电解水,导致硫酸浓度增大;
③电解稀硫酸实质是电解水,c、d两极共收集到336mL气体(标准状况),电池反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,生成氢气的体积占总体积的$\frac{2}{3}$,所以混合气体中氢气的体积是224mL,即0.01mol,根据2H++2e-═H2↑计算转移电子物质的量.
解答 解:(1)甲装置中,金属A不断溶解说明A失电子发生氧化反应而作负极,B作正极;乙中C的质量增加,说明C上银离子得电子发生还原反应,则C作原电池正极,B作负极;丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C,
故答案为:D>A>B>C.
(2)①该装置是把化学物质中的能力转化为电能,所以是化学能转变为电能;在原电池中,氢气在负极上失电子,氧气在正极上得电子,电子的流向是从负极流向正极,所以是由a到b,
故答案为:化学能转变为电能;由a到b;
②碱性环境中,该反应中负极上氢气失电子生成氢离子,电极反应式为H2+2OH--2e-═2H2O,正极上氧气得电子生成氢氧根离子,电极反应为2H2O+O2+4e-═4OH-,故答案为:2H2+4OH--4e-═4H2O(或H2+2OH--2e-=2H2O);
(3)①通电一段时间后,发现只有c、d两极上有气体产生,说明溶液中的银离子在b电极上得电子,所以b电极是阴极,则a、c是阳极,d是阴极,M是原电池正极,
故答案为:正;
②左边装置中Ag作阳极、Pt作阴极,为电镀池,阳极溶解Ag质量等于阴极析出Ag质量,相当于电解质溶液中硝酸银没有参加反应,所以硝酸银溶液浓度不变;
电解稀硫酸时,阳极上生成氧气、阴极上生成氢气,相当于电解水,硫酸的物质的量不变,溶液体积减小,导致硫酸浓度增大,
故答案为:不变;增大;
③电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的$\frac{2}{3}$,所以混合气体中氢气的体积是224mL,即0.01mol,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,
故答案为:0.02.
点评 本题考查原电池、电解池的工作原理,侧重原电池正负极的判断、燃料电池电极反应式的书写、电解池阴阳极的判断等,注意电镀和电解精炼的区别,易错点是稀硫酸中硫酸物质的量不变但溶液体积改变,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏是化学变化,可得到汽油、煤油 | |
| C. | 煤的干馏是化学变化,可以得到出炉煤气、煤焦油和焦炭 | |
| D. | 煤的气化是物理变化,是高效、清洁地利用煤的途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
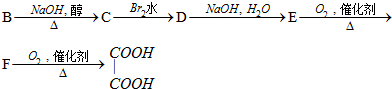
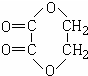
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
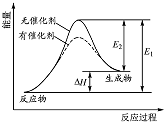
| A. | 该反应的反应物总能量高于生成物总能量 | |
| B. | 使用催化剂可以增大该反应的反应热 | |
| C. | 该化学反应的反应热为E1,且反应放热 | |
| D. | 化学反应在物质变化的同时,必然伴随能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Y | B. | 对应氢化物的沸点:M>Z | ||
| C. | 对应氢化物的稳定性:X>Y | D. | XY2与MY2溶于水都能得到对应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制备氢氧化亚铁 | B. |  石油的分馏 | ||
| C. |  测定盐酸浓度 | D. |  配制稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化学式 | A2C | A2C2 | D2C2 | D2E |
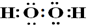 ,用电子式表示形成化合物丁的过程
,用电子式表示形成化合物丁的过程
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com