
| 1 |
| 4 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
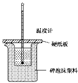 某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )
某实验小组学生按照课本实验要求,用50mL0.5mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎泡沫塑料的作用是固定小烧杯 |
| D、酸或碱的物质的量越大,所测中和热的数值越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:| O2/Cu |
| △ |
| C |
| 一定条件 |
| (1)[Ag(NH3)2]OH,△ |
| (2)H+ |
| F |
| 浓H2SO4△ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
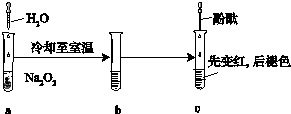 某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.
某化学小组进行Na2O2与水反应的实验,如图所示,该小组对试管c中红色褪去的原因进行探究.| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ① |
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 | |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 … | ② … | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时,NaOH和H2O2共同作用使溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量的H2S气体通入硫酸铜溶液中:H2S+Cu2+=CuS↓+2H+ |
| B、将NO2气体通入水中:2NO2+H2O=NO3-+NO↑+2H+ |
| C、ICl 和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-=I-+ClO-+H2O |
| D、往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2:2Br-+Cl2=Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
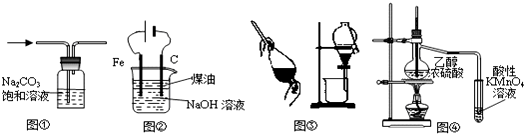
| A、图①除去CO2中的HCl |
| B、图②装置制备Fe(OH)2并能较长时间观察其颜色 |
| C、图③装置可用于分离C2H5OH和H2O的混合物 |
| D、图④证明CH3CH2OH发生消去反应生成了乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com