
| A. | Fe不能与水蒸气发生化学反应 | |
| B. | 白色Fe(OH)2在空气中放置最终变成灰绿色 | |
| C. | 铝可以与氢氧化钠溶液发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | |
| D. | 氯化铁溶液不能与铜单质发生反应 |
分析 A.高温下Fe与水蒸气反应生成四氧化三铁和氢气;
B.Fe(OH)2易被氧气氧化生成Fe(OH)3;
C.Al与NaOH溶液反应生成偏铝酸钠和氢气;
D.Cu与氯化铁反应生成氯化亚铁、氯化铜.
解答 解:A.高温下Fe与水蒸气反应生成四氧化三铁和氢气,则Fe能与水蒸气发生化学反应,故A错误;
B.Fe(OH)2易被氧气氧化生成Fe(OH)3,则白色沉淀Fe(OH)2在空气中放置最终变成红褐色,故B错误;
C.Al与NaOH溶液反应生成偏铝酸钠和氢气,则铝可以与氢氧化钠溶液发生反应为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故C正确;
D.Cu与氯化铁反应生成氯化亚铁、氯化铜,则氯化铁溶液能与铜单质发生反应,故D错误;
故选C.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+ | |
| B. | 0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84”消毒液和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+Cl-+6H+═Cl2+3H2O | |
| D. | 氯化铁溶液中滴加氢硫酸溶液:2Fe3++S2-═2Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
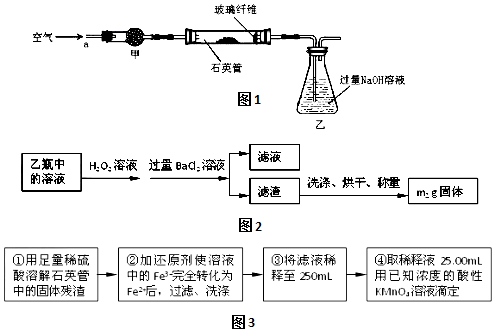
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D
;D
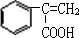 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.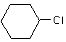 为原料合成重要的化工产品
为原料合成重要的化工产品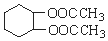 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)
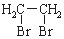
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、合成纤维、合成橡胶主要是以石油、煤和天然气为原料生产的 | |
| B. | 利用丁达尔效应可以提纯混有葡萄糖的稀淀粉溶液 | |
| C. | 氨气、二氧化碳、乙醇都属于非电解质 | |
| D. | 硫氧化物和氮氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
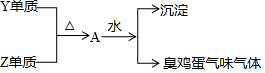 X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )
X、Y、Z、W处于同一周期的四种短周期元素,其原子序数逐渐增大,X、W分别是本周期原子半径最大和最小的主族元素,Y单质在工业上用电解其氧化物的方法制取,Y、Z形成的单质有如下转化关系图.下列说法正确的是( )| A. | Y、Z形成的化合物可利用离子反应制备 | |
| B. | X、Z形成的化合物可能含共价键 | |
| C. | 化合物XW能促进水的电离 | |
| D. | Y元素只能存在于阳离子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
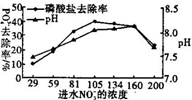 某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.
某文献报道可将ASBBR(一种生物膜反应器)用在有PO43-存在的环境中除磷,有一类微生物可在其中将PO43-还原为PH3,这项研究为解决含磷污染物的净化问题提供了新思路.某课题组在无氧环境中,用某腌制厂中含NO3-的废水对上述磷酸盐还原系统的除磷效率进行实验分析.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最终得到沉淀的质量大于$\frac{37m}{28}$g | |
| B. | 该饱和溶液质量百分比浓度为$\frac{s}{100+s}$% | |
| C. | 最终所得溶液c(OH-)不变 | |
| D. | 该饱和溶液中溶质物质的量浓度为$\frac{1000ρs}{74(100+s)}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com