
【题目】三氯甲醛(CCl3CHO)可用于生产氯霉素、合霉素等,其在实验室制备的反应原理为C2H5OH+4C12![]() CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl
CCl3CHO+5HCl,可能发生的副反应是C2H50H+ HCl ![]() C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
C2H5Cl+ H2O。某探究小组在实验室模拟制备三氯乙醛的装置如图所示(夹持、加热装置均略去)。回答下列问题:
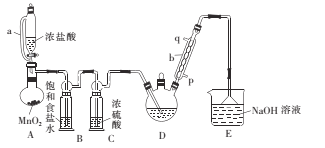
(1)仪器a的名称是____ ,采用该仪器的理由是____
(2)仪器b中冷凝水从___ (填“p”或“q”)口进。
(3)装置A中MnO2用KClO3代替,反应在常温下进行,试写出反应的离子方程式:____。若撤去装置B,对实验的影响是_______ 。
(4)测定产品纯度:
①称取0. 40 g产品,配成待测溶液,加入20. 00 mL0.100 mol/L碘标准溶液,再加适量碱液,充分反应:![]()
②再加适量盐酸调节溶液的pH,并立即用0.020 mol/L的Na2S2O3溶液滴定到终点,发生反应:I2+![]() ;
;
③重复上述操作3次,平均消耗Na2S2O3溶液20. 00 mL。
滴定时所用指示剂是____,达到滴定终点的现象是 ___,测得产品的纯度是____(保留三位有效数字)。
【答案】恒压分液漏斗 平衡漏斗上方和烧瓶内气体的压强,便于液体顺利滴下 p ClO3+6H++5Cl===3Cl2↑+3H2O 生成的氯气中混有的HCl气体会与乙醇反应生成氯乙烷,导致三氯乙醛的纯度降低 淀粉溶液 滴入最后一滴Na2S2O3溶液,锥形瓶中的颜色有蓝色变为无色,且半分钟内部恢复原色 66.4%
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中过量的氯气等防止污染空气。
MnCl2+Cl2↑+2H2O,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中过量的氯气等防止污染空气。
(1)根据仪器a的结构特点可知其为恒压分液漏斗;恒压分液漏斗的导管可以平衡漏斗上方和烧瓶内气体的压强,便于液体顺利滴下;
(2)仪器b为球形冷凝管,为了更好的冷凝效果,冷凝水应从p口进入,q口流出;
(3)装置A为浓盐酸与二氧化锰共热制取氯气,用KClO3代替二氧化锰做氧化剂,发生归中反应,离子方程式为:ClO3+6H++5Cl===3Cl2↑+3H2O;生成的氯气中混有的HCl气体会与乙醇反应生成氯乙烷,导致三氯乙醛的纯度降低;
(4)该滴定过程中利用Na2S2O3标准溶液滴定未反应的碘单质的物质的量,从而确定与HCOO反应的碘单质的量,继而确定HCOO的量;滴定终点碘单质全部被氧化成碘离子,所以可选用淀粉溶液做指示剂,达到终点的现象为滴入最后一滴Na2S2O3溶液,锥形瓶中的颜色有蓝色变为无色,且半分钟内部恢复原色;
根据反应I2+![]() 可知存在数量关系I2~2 S2O32,则剩余的n(I2)= 0.020 mol/L×0.02L×
可知存在数量关系I2~2 S2O32,则剩余的n(I2)= 0.020 mol/L×0.02L×![]() =0.00020mol,则与HCOO反应的n(I2)= 0.100 mol/L×0.02L-0.00020mol=0.00180mol,根据
=0.00020mol,则与HCOO反应的n(I2)= 0.100 mol/L×0.02L-0.00020mol=0.00180mol,根据![]() ,可知n(CCl3CHO)=0.00180mol, 产品的纯度为
,可知n(CCl3CHO)=0.00180mol, 产品的纯度为![]() 66.4%。
66.4%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂。某化学兴趣小组拟设计 实验制备少量的S2Cl2,査阅资料知:
①干燥的氯气在 110℃~140℃与硫反应,即可得到 S2Cl2。
②S 的熔点为 112.8℃、沸点为 444.6℃;S2Cl2 的熔点为-76℃、沸点为 138℃。
③S2Cl2+Cl2![]() 2SCl2。
2SCl2。
④S2Cl2 易和水发生歧化反应。

该小组设计的制备装置如如图(夹持仪器和加热装置已略去)
(1)连接好实验装置后的第一步实验操作是____________。
(2)A 装置中制取氯气的离子反应方程式_____________。
(3)装置 B、C 中的试剂分别是_____________,_____________; 若实验中缺少 C 装置,发现产品浑浊不清,请用化学方程式表示其原因____________。
(4)该实验的操作顺序应为_____________(用序号表示)。
①加热装置 A ②加热装置 D ③通冷凝水 ④停止加热装置 A ⑤停止加热装置 D
(5)图中 G 装置中应放置的试剂为______________,其作用为______________。
(6)在加热 D 时温度不宜过高,其原因是_______________; 为了提高 S2Cl2 的纯度,关键的操作是控制好温度和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《Nature Energy》报道了巾科院大连化学物理研究所科学家用Ni- BaH2 /Al2O3、Ni- LiH等作催化剂,实现了在常压、100-300℃的条件下合成氨。
(1)在元素周期表中,氧和与其相邻且同周期的两种元素的第一电离能由大到小的顺序为 __ ;基态Ni2+的核外电子排布式为 ___,若该离子核外电子空间运动状态有15种,则该离子处于 ___(填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中NO3的空间构型为____。
②甘氨酸中N原子的杂化类型为____,分子中σ键与π键的个数比为____,晶体类型是 ___,其熔点、沸点远高于相对分子质量几乎相等的丙酸(熔点为-2l℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是____。
(3)NH3分子中的键角为107°,但在[Cu(NH3)4]2+离子中NH3分子的键角如图l所示,导致这种变化的原因是____

(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为d pm,密度为ρg/cm3,则阿伏加德罗常数NA=____(列出表达式)mol-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为确定某烃的分子式及其可能的结构简式,做了如下实验:标准状况下,取0.1mol某烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4L,同时得到16.2g水。
(1)该烃的摩尔质量为______________。
(2)该烃的分子式为____________________。
(3)该烃有一种可能的结构为 ,其系统命名为___________。
,其系统命名为___________。
(4) 属于______________(选填序号)。
属于______________(选填序号)。
a.环烃b.烷烃c.芳香烃d.不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒酚是植物挥发油的成分之一,它的结构简式是![]() ,下列叙述中不正确的是 ( )
,下列叙述中不正确的是 ( )
A.1 mol胡椒酚最多可与4 mol H2发生反应
B.1 mol胡椒酚最多可与4 mol Br2发生反应
C.胡椒酚可与NaOH溶液反应
D.胡椒酚在水中的溶解度不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:
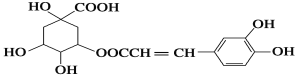
关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L苯中含C-H数目为0.6 NA
B.常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
C.常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com