
 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),D的核磁共振氢谱有3组峰,DMP的分子式为C10H10O4.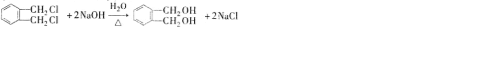 .
.
分析 邻二甲苯和氯气在一定条件下发生取代反应生成氯代烃A,A和氢氧化钠的水溶液发生取代反应生成醇B,B被氧气氧化生成生成醛C,C被氧气氧化生成羧酸D,D和醇发生酯化(取代)反应生成DMP,根据DMP 的结构知邻二甲苯中甲基上1个氢原子被氯原子取代,所以A的结构简式为: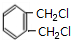 ,B是
,B是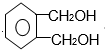 ,C是
,C是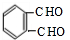 ,D是
,D是 ,邻二苯甲酸和醇发生酯化反应生成DMP,DMP蒸气对氢气的相对密度为97,则DMP的相对分子质量为194,则该醇是甲醇,故DMP的结构简式为:
,邻二苯甲酸和醇发生酯化反应生成DMP,DMP蒸气对氢气的相对密度为97,则DMP的相对分子质量为194,则该醇是甲醇,故DMP的结构简式为: ,据此答题.
,据此答题.
解答 解:邻二甲苯和氯气在一定条件下发生取代反应生成氯代烃A,A和氢氧化钠的水溶液发生取代反应生成醇B,B被氧气氧化生成生成醛C,C被氧气氧化生成羧酸D,D和醇发生酯化(取代)反应生成DMP,根据DMP 的结构知邻二甲苯中甲基上1个氢原子被氯原子取代,所以A的结构简式为: ,B是
,B是 ,C是
,C是 ,D是
,D是 ,邻二苯甲酸和醇发生酯化反应生成DMP,DMP蒸气对氢气的相对密度为97,则DMP的相对分子质量为194,则该醇是甲醇,故DMP的结构简式为:
,邻二苯甲酸和醇发生酯化反应生成DMP,DMP蒸气对氢气的相对密度为97,则DMP的相对分子质量为194,则该醇是甲醇,故DMP的结构简式为: ,
,
(1)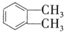 的名称是1,2-二甲苯(或邻二甲苯),D是
的名称是1,2-二甲苯(或邻二甲苯),D是 ,D的核磁共振氢谱有3组峰,DMP的结构简式为:
,D的核磁共振氢谱有3组峰,DMP的结构简式为: ,所以DMP的分子式为C10H10O4,
,所以DMP的分子式为C10H10O4,
故答案为:1,2-二甲苯(或邻二甲苯);3;C10H10O4;
(2)A→B是卤代烃的碱性水解,反应的化学方程式为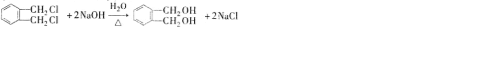 ,
,
故答案为: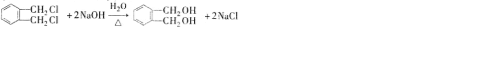 ;
;
(3)根据元素守恒可知,反应①还有另外一种产物为H2O,DMP的结构简式为: ,反应②中的另一产物是水,且n(F):n(H2O)=2:1,则F的结构简式为 CH3OH,
,反应②中的另一产物是水,且n(F):n(H2O)=2:1,则F的结构简式为 CH3OH,
故答案为:H2O; CH3OH.
点评 本题考查了有机物的推断,明确有机物的官能团及其结构是解本题关键,采用正逆相结合的方法进行推断,难点是同分异构体种类的推断,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物不一定含有金属元素 | B. | 分子晶体中一定含有共价键 | ||
| C. | 原子晶体熔化时破坏共价键 | D. | 离子化合物中可以含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 在外电路中电子由负极沿导线流向正极 | |
| C. | 1mol乙醇被氧化转移6mol电子 | |
| D. | 电解质溶液中阳离子移向正极,阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 | |
| C. | 碳酸铯受热易分解 | |
| D. | 硒化氢是无色、有毒、比硫化氢稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 太阳能是地球上最基本的能源,绿色植物通过光合作用将太阳能转化成化学能 | |
| B. | 农业上的秸秆、枝叶、水生植物、动物粪便及城市和工业的有机废弃物都蕴藏着丰富的生物质能 | |
| C. | 生活垃圾送入焚烧炉产生的热量可发电、供暖,焚烧炉产生的气体可直接排放 | |
| D. | 氢能是理想的清洁能源,但氢气的水制备氢气的能耗、贮存、运输等一直阻碍着人们大量利用氢能的步伐;贮氢合金的发现和利用,开辟了解决氢气贮存、运输难题的新途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
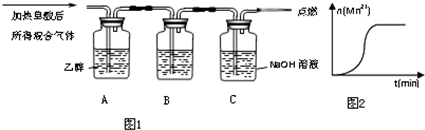
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com