
| A、1:2:3 |
| B、.1:1:1 |
| C、3:2:1 |
| D、2:1:1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂的摄入有利于人体对某些维生素的吸收 |
| B、铝硅酸盐分子筛能用于分离提纯气体或液体混合物,不能做干燥剂和催化剂 |
| C、水在4℃时有(H2O)2存在,两个水分子间以某种特殊的分子间作用力相结合 |
| D、利用乙醇的还原性,可用经硫酸酸化处理的三氧化铬硅胶检验酒后驾车 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸的导电性比乙酸溶液的导电性强,说明乙酸是弱酸 |
| B、因为氧化钾溶于水能导电,所以氧化钾是电解质 |
| C、强电解质中一定含有离子键,弱电解质中一定含有弱极性共价键 |
| D、某物质能导电,说明该物质一定含有能自由移动的带电荷的微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该条件下反应的平衡常数为1.6×103 |
| B、通常情况下,该反应一定能自发进行 |
| C、题给条件下,O2的转化率是20% |
| D、当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为冰晶体的结构模型,大球代表O原子,小球代表H原子.下列有关说法正确的是( )
如图为冰晶体的结构模型,大球代表O原子,小球代表H原子.下列有关说法正确的是( )| A、冰晶体中每个水分子与另外四个水分子形成四面体 |
| B、冰晶体具有空间网状结构,是原子晶体 |
| C、水分子间通过H-O键形成冰晶体 |
| D、冰晶体熔化时,水分子之间的空隙增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
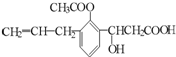 ,则此有机物可发生的反应类型有( )
,则此有机物可发生的反应类型有( )| A、①②④⑤⑥⑦⑧ |
| B、②③④⑤⑥⑧ |
| C、②③④⑤⑥⑦⑧ |
| D、①②③④⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com