
| 529KJ×2mol | ||
|
| 1mol×17.56KJ | ||
|
| 529KJ×2mol | ||
|
| 1mol×17.56kJ | ||
|


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
| A、8:1 |
| B、108:35.5 |
| C、35.5:108 |
| D、16:207 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有两个起始体积相同的密闭容器A和B,A容器为固定体积;B容器有一个可移动的活塞,能使容器内保持恒压.起始时这两个容器分别充入等量的SO3气体,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO3?2SO2+O2,并达到平衡.
有两个起始体积相同的密闭容器A和B,A容器为固定体积;B容器有一个可移动的活塞,能使容器内保持恒压.起始时这两个容器分别充入等量的SO3气体,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO3?2SO2+O2,并达到平衡.查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.2 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
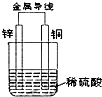 如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )| A、能将电能转换为化学能 |
| B、溶液会逐渐变为蓝色 |
| C、锌片是负极,发生氧化反应 |
| D、外电路中电子由铜片经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
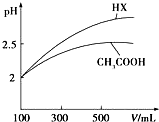 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com