
| A. | 颜色 | B. | 质量 | C. | 压强 | D. | 密度 |
分析 升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进--化学平衡2NO2?N2O4向左进行,生成二氧化氮浓度增大,颜色加深,发生改变,但是气体的总质量是守恒的,所以质量不变,所以总的物质的量增大了,所以压强会发生改变,气体的总质量是守恒的,烧瓶的体积也是不变的,所以密度不变,由此分析解答.
解答 解:升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行.
A、化学平衡2NO2?N2O4向左进行,生成二氧化氮浓度增大,颜色加深,发生改变,故A错误;
B、化学平衡2NO2?N2O4向左进行,但是气体的总质量是守恒的,所以质量不变,故B正确;
C、化学平衡2NO2?N2O4向左进行,所以总的物质的量增大了,所以压强会发生改变,故C错误;
D、化学平衡2NO2?N2O4向左进行,气体的总质量是守恒的,烧瓶的体积也是不变的,所以密度不变,故D正确;
故选:BD.
点评 本题考查学生温度对化学平衡的影响知识,注意化学反应中质量守恒,可以根据所学知识来回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中,除第一和第七周期外,第n周期所含非金属元素的种数均为(8-n) | |
| B. | SiCl4、PCl3分子中各原子最外层均达到8电子稳定结构 | |
| C. | 气态氢化物的水溶液都是酸 | |
| D. | ⅠA族和ⅥA族元素形成的原子个数比1:1、电子总数38的化合物,是有共价键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠 | |
| B. | 硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵 | |
| C. | 硫酸、氢氧化钠、氮化钙、氢氧化钡 | |
| D. | 氯化铵、氢氧化钠、双氧水、过氧化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3n-12 | B. | 3n-6 | C. | 3n-4 | D. | 2n-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
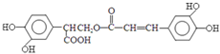
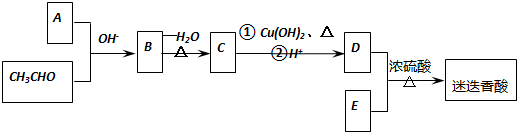
 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$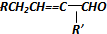
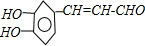 .
.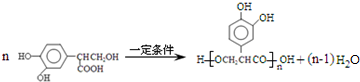 .
.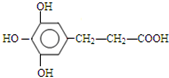 、
、 、
、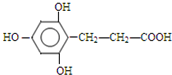 、
、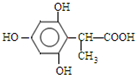 (任一种).
(任一种).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可能是N2与NO2的混和气体 | B. | 可能是N2与NO的混和气体 | ||
| C. | 可能是NO与NO2的混和气体 | D. | 可能是NO2一种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
; (其中两种)(任意两种)
(其中两种)(任意两种)
 ,该反应的反应类型是取代反应.
,该反应的反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com