
| A. | 氢是宇宙物质中含量最多的元素 | |
| B. | 氢是名副其实的碱金属元素 | |
| C. | 氢气是无污染的新型能源 | |
| D. | 固态“金属氢”汽化的过程属于物理变化 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y | |
| B. | 第一电离能:X>Y | |
| C. | 气态氢化物的稳定性:HmY小于HnY | |
| D. | X与Y形成化合物时,一般显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
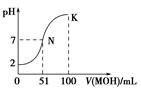 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )| A. | HA为一元强酸 | |
| B. | MOH为一元弱碱 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CO32ˉ+2H+═H2O+CO2↑ | |
| B. | 稀硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铁粉与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 稀硫酸与氢氧化钠溶液反应:H++OHˉ═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果汁中的Fe2+变成Fe3+ | B. | 苹果汁中含有Cu2+ | ||
| C. | 苹果汁含有OH- | D. | 苹果汁含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{46}$Ti比${\;}_{22}^{47}$Ti少1个质子 | |
| B. | ${\;}_{22}^{46}$Ti和${\;}_{22}^{47}$Ti的化学性质相同 | |
| C. | ${\;}_{22}^{46}$Ti的相对原子质量是46 | |
| D. | ${\;}_{22}^{47}$Ti的原子序数为47 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com