
(15分)重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
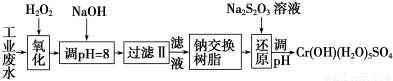
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O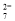 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O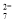 的废水:
的废水:
该法用Fe作电极电解含Cr2O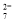 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O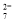 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5 mol·L-1。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
25℃时,在浓度均为1 mol/L的溶液中,各组离子一定能大量共存的是
A.盐酸中:K+、Mg2+、Fe2+、MnO7-、
B.NaOH溶液中:Cu2+、NH4+、SO42-、CO32-
C.FeCl3溶液中:Al3+、Na+、SCN-、SO42-
D.NaClO溶液中:K+、SO42-、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市通州区高三模拟考试(一)理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关,下列说法正确的是
A.加碘食盐中添加的是碘化钾
B.味觉上具有酸味的食物就是酸性食物
C.Fe3O4俗称铁红,常做红色油漆和涂料
D.晶体硅具有半导体性质,可用于生产计算机芯片
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:实验题
(15分)硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂。它易溶于水,难溶于酒精,受热、遇酸易分解。工业上可用硫化碱法制备,反应原理:2Na2S + Na2CO3 + 4SO2=3Na2S2O3 + CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
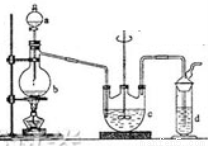
(1)b中反应的离子方程式为_________________________,c中试剂为__________。
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是____________。
(3)控制b中的溶液的pH接近7,停止通入SO2。若未控制好,pH<7,会影响产率,原因是(用离子方程式表示) 。
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为________。
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式) 。
(6)实验中要控制SO2生成速率,可采取的措施有________________(写出一条)。
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点。实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
则该产品的纯度是 ,(用百分数表示,保留1位小数)间接碘量法滴定过程中可能造成实验结果偏低的是 。
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 molCl2与足量Fe反应转移电子数一定为3NA
B.1mol SiO2晶体中含NA个SiO2分子
C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
D.标准状况下,22.4L氨水含有NA个NH3分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
研究发现,奥司他韦可以有效治疗H1N1流感,奥司他韦分子式为C16H28N2O4·H3PO4,分子结构如图。下列有关奥司他韦的说法中正确的是
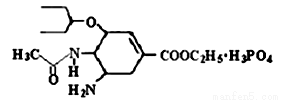
A.含极性键,易溶于水,其水溶液有丁达尔效应
B.分子中含有酯基、氨基、苯环等官能团
C.1mol 该物质最多能与3molNaOH反应
D.可以发生加成、取代、氧化反应、还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高三3月教学质量监测理综化学试卷(解析版) 题型:简答题
【化学——选修2:化学与技术】(15分)研究化肥的合成、废水的处理等有现实的重要意义。
(1)硝酸铵的生产方法是采用硝酸与氨气化合,工业合成氨是一个放热反应,因此低温有利于提高原料的转化率,但实际生产中却采用400~500℃的高温,其原因是__________________;工业生产中,以氨气为原料合成硝酸,写出工业生产硝酸的最后一步的化学方程式________________________________。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:

已知CO+H2O CO2+H2①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的
CO2+H2①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的
物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?_____________________。
(3)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等。
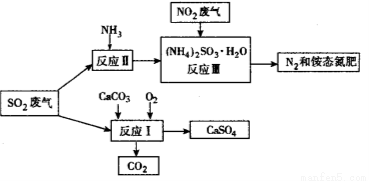
①写出反应Ⅰ的化学方程式:_________________________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________。
③检验经过反应Ⅲ得到的氨态氮肥中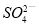 所用试剂是_______________________。
所用试剂是_______________________。
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。

①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是____________________。
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省新校高三4月模拟化学试卷(解析版) 题型:选择题
(1)已知t ℃时AgCl的Ksp=2×10-10 (2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
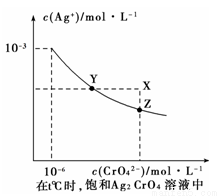
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t ℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列化学式只能表示一种物质的是
A、C3H8 B、C4H10 C、C4H8 D、C2H6O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com