
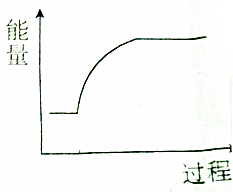
| A. | 钠与水反应 | B. | 钠的熔化过程 | ||
| C. | 氢氧化钠溶液与稀盐酸反应 | D. | Na2O2+H2O→NaOH+O2(未配平) |
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
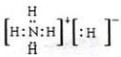 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
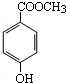 .
. ,其中包含的反应类型有取代反应或水解反应、中和反应.
,其中包含的反应类型有取代反应或水解反应、中和反应.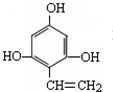 、
、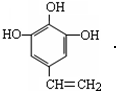 .
.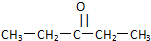
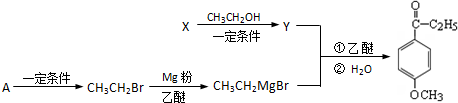
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
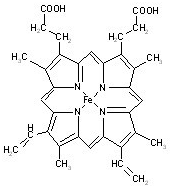 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.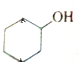 )中有3个手性碳原子.
)中有3个手性碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子的双键中有一键较易断裂 | |
| B. | 烯分子里所有原子都在同一个平面上,且碳氢键之间的键角约为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷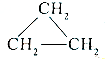 的分子组成符合通式CnH2n,因此它们属于同系物 的分子组成符合通式CnH2n,因此它们属于同系物 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子.则该硫酸盐的物质的量浓度为
A.2 mol•L﹣1 B.7.5 mol•L﹣1 C.5 mol•L﹣1 D.2.5 mol•L﹣1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(一题多变题组)关于物质的量各物理量之间的相互转化
(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为___________;同质量的氨气和硫化氢气体的物质的量比为_____________,所含原子个数比为__________;若两者所含氢原子数相等,它们的物质的量比是_____________。
(2)标准状况下,①4 g氢气、② 33.6 L甲烷、③ 6.02×10 23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
(3)现有质量为a g某气体A2B,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:该气体的物质的量为_____ ___mol,该气体所含原子总数为___ ____个,该气体在标准状况下的体积为____________L。
(学法题)通过解答本题,在解题时应先将各种已知量转化为 再进行计算。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com