
����Ŀ��ij��ѧС���о����ᱻ��������������������ʵ�飮
��1���о����ᱻMnO2������
ʵ�� | ���� | ���� |
I | �����½�MnO2��12molL-1Ũ������ | ��Һ��dz��ɫ�����д̼�����ζ |
II | �� I�л������ˣ�������Һ | ���ɴ�������ɫ���� |
III | ����MnO2��4molL-1ϡ�������� | ���������� |
����֪MnO2�������ԣ�I����Һ��dz��ɫ������MnO2��Ũ���ᷢ���˸��ֽⷴӦ����ѧ����ʽ��______��
��II�з����˷ֽⷴӦ����Ӧ�Ļ�ѧ����ʽ��______��
��III�������������ԭ������c��H+����c��Cl-���ϵͣ����ʵ�飨ͼ1��IV����̽����

��ʵ�� III��IV���Աȣ��ó��Ľ�����______���� i��ii���Աȣ��ó��Ľ�����______��
����ͼ2װ�ã�a��b��Ϊʯī�缫������ʵ�� V��
����K�պ�ʱ��ָ������ƫת
�������ҹ��еμ�ŨH2SO4��c��H+����7molL-1��ָ��ƫת���ȱ仯����
������������еμ�ŨH2SO4��c��H+����7molL-1��ָ������ƫת��������
�����͢��������Աȣ��ó��Ľ�����______��
��2���о������ܷ���������������
����ƿ�з���ŨH2SO4��ͨ����Һ©������ƿ�еμ�Ũ���ᣬ��ƿ�Ϸ�����������������ʪ��ĵ���KI��ֽ���飬�����������ɴ˵ó�Ũ����______����ܡ����ܡ����������ᣮ
�����Թ��м���3mLŨ���ᣬ�ټ���1mLŨHNO3���Թ���Һ����Ϊ��ɫ�����ȣ������ػ�ɫ���壬�����麬��NO2��
ʵ�� | ���� | ���� |
I | ��ʪ��ĵ���KI��ֽ�����ػ�ɫ������ | ��ֽ�ȱ���������ɫ |
II | ��ʪ��ĵ���KI��ֽ���봿��Cl2�� | ��ֽ�ȱ���������ɫ |
III | �� | �� |
ͨ��ʵ��I��II��III֤����������к���Cl2��III�IJ�����______��
��3��������ʵ��ó��������ܷ������������������ࡢ______�йأ�
���𰸡� MnO2+4HCl�TMnCl4+2H2O��MnCl4�TCl2��+MnCl2 III��û�����������ԭ����c��H+����c��Cl-���ϵͣ���Ҫ����һ��Ũ�Ȳ��ܱ�MnO2���� MnO2��������ķ�Ӧ��c��H+���仯��Ӱ�����c��Cl-�� HCl�Ļ�ԭ����c��H+���� MnO2����������c��H+���йأ�c��H+��Խ��MnO2��������Խǿ ���� ��ʪ��ĵ���KI��ֽ���봿����NO2�� c��Cl-����c��H+��
�����������������(1). �ٸ��ֽⷴӦ��Ԫ�ػ��ϼ۲�������II�з����˷ֽⷴӦ�����ɻ���ɫ������������������ԭ���ɻ�����MnCl2���۽�ʵ�� III��IV���Աȣ����Կ�����c��H+����c��Cl-����Ҫ����һ��Ũ�Ȳ��ܱ�MnO2�������� i��ii���Աȿ��Կ�����c��H+����7�ų������� c��Cl-����10���ܷų��������ܢ�����c��H+��Ũ����ͬ��������ͬ��˵��HCl�Ļ�ԭ����c��H+��������2������ʪ��ĵ���KI��ֽ���飬������������˵��û�������������ڽ�ʪ��ĵ���KI��ֽ���봿����NO2�У�����ֽ��������ɫ����֤��������������3�������ܷ���������������������Cl-��H+Ũ���й���
������(1). �ٸ��ֽⷴӦ��Ԫ�ػ��ϼ۲���������MnO2��Ũ���ᷢ�����ֽⷴӦ�Ļ�ѧ����ʽ��MnO2+4HCl�TMnCl4+2H2O����II�з����˷ֽⷴӦ�����ɻ���ɫ����������������ԭ���ɻ�����MnCl2����Ӧ�ķ���ʽ��MnCl4�TCl2��+MnCl2���۽�ʵ�� III��IV���Աȣ�III��û�����������ԭ����c��H+����c��Cl-���ϵͣ���Ҫ����һ��Ũ�Ȳ��ܱ�MnO2�������� i��ii���Աȿ��Կ�����c��H+����7�ų������� c��Cl-����10�ų�����������MnO2��������ķ�Ӧ��c��H+���仯��Ӱ�����c��Cl-�����ܢ�����c��H+��Ũ����ͬ��������ͬ��˵��HCl�Ļ�ԭ����c��H+������MnO2����������c��H+���йأ�c��H+��Խ��MnO2��������Խǿ����2������ʪ��ĵ���KI��ֽ���飬������������˵��û����������������Ũ����������������ڽ�ʪ��ĵ���KI��ֽ���봿����NO2�У�����ֽ��������ɫ����֤��������������3�������ܷ���������������������c��Cl-����c��H+���й���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڡ�������ɫ����д���������������������ں�������¹��Ǹ������չ����ģ��ߴ������Ĺ�ľ�����²β�İ߲��ĺ�Ӱ�������������¹�������γɵ�����������˵������ȷ����
A.����һ�ֽ���B.����һ�ֽ���
C.�����е�Сˮ�ο�����СԼΪ10-9m��10-7mD.���������ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����K2Cr2O7��Һ����FeSO4��Ӧ����Fe3+��Cr3+ �� �ֽ������ữ��K2Cr2O7��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ������˵���в���ȷ���ǣ� �� 
A.ͼ��AB�ε�������ΪK2Cr2O7
B.ͼ��BC�η����ķ�ӦΪ2Fe3++2I��=2Fe2++I2
C.��ʼ�����K2Cr2O7Ϊ0.25 mol
D.K2Cr2O7����FeSO4��Ӧ�����ʵ���Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ�������ʳ�õİ��ǡ����Ǻͺ��ǵ���Ҫ�ɷ��ǣ�������
A.����
B.������
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������pH=2��pH=4�������з�����ʴ�����ܱ������У���ѹǿ��������¼�ù��̵�ѹǿ�仯����ͼ��ʾ������˵���У�����ȷ���ǣ�������
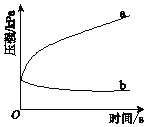
A. �������и�����Ӧ��ΪFe-2e-�TFe2+
B. ����a��¼����pH=2��������ѹǿ�ı仯
C. ����b��¼��������������Ӧ��O2+4e-+2H2O�T4OH-
D. ����������Һ�У������ܷ���������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. C��H��O��N��P��Fe B. C��H��O��S��N��P
C. H��O��K��S��P��Mg D. N��P��K��Ca��S��Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʹ�ý�������ʷ�����У�������ͭ��������֮�����ֽ����㷺Ӧ�õĽ�������ѧ��Ԥ�����ѣ�Ti����������Ϊ��δ�����͵Ľ��������Իش��������⣺ 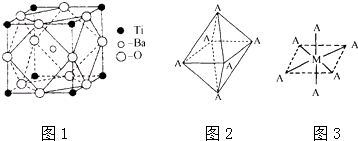
��1��TiԪ����Ԫ�����ڱ��е�λ�������̬ԭ�ӵĵ����Ų�ʽΪ ��
��2����Ti�Ļ������У����Գ���+2��+3��+4���ֻ��ϼۣ�������+4�۵�Ti��Ϊ�ȶ���ƫ���ᱵ�����ȶ��Ժã���糣���ߣ���С�ͱ�ѹ������Ͳ���������ж���Ӧ�ã�ƫ���ᱵ�����о����Ľṹʾ��ͼ��ͼ1��ʾ�����Ļ�ѧʽ�� �� ����Ti4+������λ��Ϊ �� Ba2+������λ��Ϊ ��
��3�������µ�TiCl4���д̼��Գ�ζ����ɫ��Һ�壬�۵㩁23.2�棬�е�136.2�棬TiCl4�ڳ�ʪ�������ӷ���ˮ���ð���̣�������Ϊˮ��������ɣ�
��4����֪Ti3+���γ���λ��Ϊ6��������ռ乹��Ϊ�������壬����ͼ2��ʾ������ͨ����������ͼ3��ʾ�ķ�������ʾ��ռ乹�ͣ�����A��ʾ���壬M��ʾ����ԭ�ӣ�����λ������[Co��NH3��4Cl2]�Ŀռ乹��ҲΪ�������ͣ�������ͬ���칹�壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X�Ľṹ��ʽ��ͼ��ʾ����1mol X�ֱ���H2 �� Na��NaOH��NaHCO3ǡ����ȫ��Ӧ��������H2 �� Na��NaOH��NaHCO3�����ʵ���֮��Ϊ�� �� 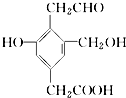
A.4��3��2��1
B.3��3��2��1
C.4��3��2��2
D.3��3��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͼ���˵����ȷ����
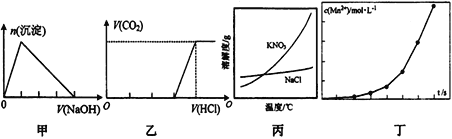
A. ͼ�ɱ�ʾ����ijAlCl3��Һ�еμӹ�����NaOH ��Һ�����ɳ��������ʵ�����μ�NaOH ��Һ����Ĺ�ϵ
B. ͼ�ҿɱ�ʾ�������ʵ�����NaOH ��Na2CO3�Ļ����Һ�еμӹ�����ϡ���ᣬ��������������μ�HCl ��Һ����Ĺ�ϵ
C. ����ͼ������ȥ����KNO3��������NaCl����������Ũ�������ȹ������ķ���
D. ͼ���ɱ�ʾ����һ�������������Һ���ữ�IJ�������Һ��ϣ���ӦҺ��Mn2+��Ũ���淴Ӧʱ��t�ı仯��ϵ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com