
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
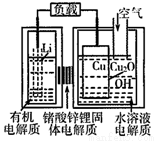
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,正极的电极反应式为O2+2H2O+4e-═4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二下第十二周练化学卷(解析版) 题型:填空题
填写下列各空。
(1)H2O分子构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
(2)SO3分子构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
(3)HCN分子构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
(4)CH4分子构型 ,中心原子采取 杂化,属于 分子(填极性或非极性)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:填空题
四苯基乙烯(TPE)及其衍生物具有聚集诱导发光特性,在光电材料等领域应用前景广阔。以下是TPE的合成路线(部分试剂和反应条件省略):

(1)A的名称是 ;试剂Y为 。
(2)B→C的反应类型是 ;B中官能团的名称是 ; D中官能团的名称 。
(3)E→F的化学方程式是 。
(4)W是D的同分异构体,具有下列结构特征:属于萘( )的一元取代物;存在羟甲基(—
)的一元取代物;存在羟甲基(—
CH2OH)。写出W所有可能的结构简式: 。
(5)下列说法正确的是 ( )
a.B的酸性比碳酸强 b.D不能发生还原反应
c.E含有3种不同化学环境的氢 d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:选择题
据报道,1995年化学家合成了一种分子式为C200H200的有机物,它是含多个碳碳叁键(-C≡C-)的链状烃,则分子中含碳碳叁键最多是
A.49个 B.50个 C.51个 D.不能肯定
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:填空题
氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________。
(3)N2F2分子中N原子的杂化方式是__________,l mol N2F2含有__________molσ键.
(4)NF3的键角__________NH3的键角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________.
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为__________,Na2O晶体的密度为__________g•cm-3(只要求列算式,不必计算出结果)。

查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则一中高三下学期二模考试理综化学试卷(解析版) 题型:选择题
下表中相关物质的信息都正确的一项是( )
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
B | H2O2 |
| 不稳定,易分解 | 医用消毒剂 |
C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:选择题
某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) →PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0064 mol/(L·s)
B.若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的△H﹤0
C.相同温度下,起始时向该容器中充入 4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于 80%
D.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高中高三第四次模拟理综化学试卷(解析版) 题型:选择题
下列物质与类别不对应的是
A | B | C | D |
小苏打
| 食用油
| 淀粉
| 84消毒液
|
盐 | 高分子化合物 | 糖类 | 混合物 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
含氮化合物是化学与工业中运用广泛的物质。
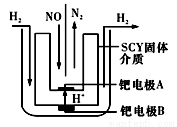
(1)该小组利用电解原理设计了如右图装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极)。铂电极B是____极,钯电极A的电极反应式为_____________。
(2)若工业废水中的NO2- 的浓度约为1.0×10-4 mol·L-1 ,取工业废水5 mL 于试管中,滴加2滴0.1 mol·L-1 的硝酸银溶液,能否看到沉淀现象?试通过计算说明。(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol。请计算热化学方程式2H2(g) + S2(g) = 2H2S(g)的ΔH=___________
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)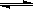 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
已知:NH2COONH4+2H2O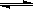 NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
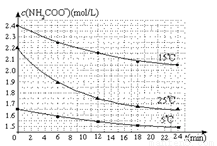
根据图中信息,如何说明水解反应速率随温度升高而增大:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com