
【题目】自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4 . 在该反应中( )
A.产物中的SO ![]() 有一部分是氧化产物
有一部分是氧化产物
B.5molFeS2发生反应,有10mol电子转移
C.发生氧化反应和发生还原反应的FeS2之比为7:3
D.14mol CuSO4能氧化5molFeS2
【答案】A
【解析】解:A、由化学方程式可知,反应物中含有14molSO42﹣离子,生成物中有17molSO42﹣离子,则有3molS被氧化,产物中的SO42﹣有一部分是氧化产物,故A正确;B、5molFeS2发生反应,Cu元素化合价由+2价→+1价,14molCuSO4得到14mol电子,FeS2→Cu2S,S元素的化合价由﹣1价→﹣2价,生成7molCu2S,得到7mol电子,有21mol电子转移,故B错误;
C、由方程式可知,5molFeS2参加反应,生成7molCu2S,被还原,所以发生还原反应的FeS2为3.5mol,但是发生氧化反应的FeS2还有1.5mol,发生氧化反应和发生还原反应的FeS2之比为3:7,故C错误;
D、Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2既是氧化剂又是还原剂,是14molCuSO4还有一部分FeS2做氧化剂,所以14mol硫酸铜氧化FeS2小于5mol,故D错误.
故选A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义.
(1)高湿条件下,写出大气中SO2转化为HSO3﹣的方程式:
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图如下: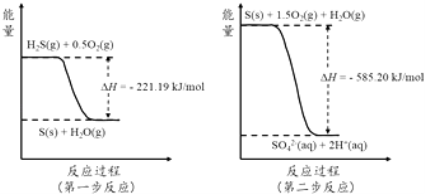
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为 .
(3)二氧化硫﹣空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下: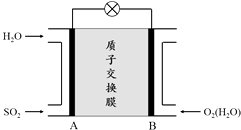
①质子的流动方向为(“从A到B”或“从B到A”).
②负极的电极反应式为 .
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键.SO2烟气脱除的一种工业流程如下: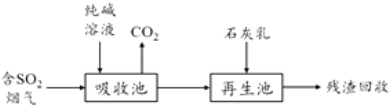
①用纯碱溶液吸收SO2将其转化为HSO3﹣ , 反应的离子方程式是 .
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图:
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示:
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: .
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 .
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 .
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
A.CO2(CO):O2
B.MgO(Al2O3):NaOH溶液
C.NaHCO3溶液(Na2CO3):过量的CO2
D.CO2(HCl):饱和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列热化学方程式
① C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
② H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣285.8kJ/mol
O2(g)═H2O(l)△H2=﹣285.8kJ/mol
③ CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
A.△H=﹣488.3 kJ/mol
B.△H=+244.1 kJ/mol
C.△H=﹣996.6 kJ/mol
D.△H=+996.6 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和Si是合成新型非金属材料的两种重要元素.请回答:
(1)基态Si原子的价层电子排布图为;其2p能级的轨道有个伸展方向,电子云的形状为 .
(2)Si原子可形成多种氢化物,其中Si2H4中Si原子的价层电子对数目为 , Si原子的杂化轨道类型为 .
(3)N和Si形成的原子晶体中,N原子的配位数为 .
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色.大多数金属元素有焰色反应的微观原因为;N3﹣中σ键和π键的数之比为 . B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为(用元素符号表示).
(5)NaNO2是一种重要的工业原料,NO2﹣的空间构型为 .
(6)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成. 
则:①晶胞中最小的环含有个原子.
②若晶体密度为ρgcm﹣3 , 阿伏伽德罗常数为NA , 晶胞中两个最近的Si原子核之间的距离为pm(用代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅酸盐材料的说法错误的是
A.普通玻璃的主要成份是SiO2
B.生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
C.陶瓷的主要原料是黏土
D.硅酸盐水泥以石灰石和黏土原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com