
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是________(填序号)。
A. Cl2 B. 淡水 C. 烧碱 D. 食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是______。
(3)下图是从海水中提取镁的简单流程。
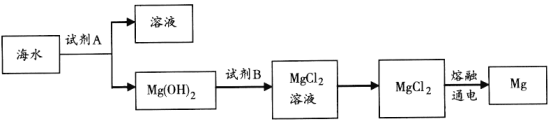
工业上常用于沉淀Mg2+的试剂A的俗名是________,氢氧化镁转化为MgCl2的离子方程式是_______。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
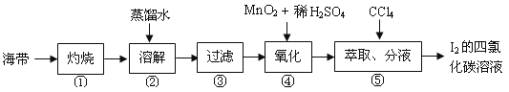
①灼烧海带至灰烬时所用的主要仪器名称是________________。步骤②加热煮沸一会的目的是_______________________________
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_____________________。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈________色。从碘的提取CCl4提取碘可以用_______的方法。
【答案】BD 2Br- + Cl2 = Br2 +2 Cl- 熟石灰 Mg(OH)2+2H+= Mg2++ 2 H2O 坩埚 促使海带灰中含碘物质快速充分溶解 2I- + H2O2 + 2H+ = I2 + 2 H2O 紫或紫红 反萃取
【解析】
(1)从海水制备物质的原理可以知道,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理,淡水利用蒸馏原理来得到;
(2)海水中加入熟石灰沉淀镁离子过滤得到氢氧化镁沉淀,加入试剂B为盐酸,氢氧化镁转化为氯化镁溶液,浓缩蒸发结晶得到氯化镁固体,电解熔融氯化镁得到金属镁和氯气,
(3)工业上常用于沉淀Mg2+的试剂A是氢氧化钙,Mg(OH)2溶于盐酸生成MgCl2的溶液;
(4)①依据仪器的名称作答;升高温度可加快化学反应速率;
②氢离子和过氧化氢将碘离子氧化为单质碘,依据氧化还原反应规律书写;碘的CCl4溶液呈紫色,结合实验步骤作答。
(1)A.电解饱和氯化钠溶液得到烧碱、氢气、氯气,有新物质生成属于化学变化,A项错误;
B.把海水用蒸馏等方法可以得到淡水,属于物理变化,B项正确;
C.电解饱和氯化钠溶液得到烧碱、氢气、氯气,有新物质生成属于化学变化,C项错误;
D.把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,D项正确;
答案选BD;
(2)氯气具有强氧化性,能和溴离子发生置换反应生成溴,离子方程式为:Cl2+2Br-=Br2+2Cl-。
(3)工业上常用石灰乳或氧化钙沉淀Mg2+,CaO和H2O反应生成Ca(OH)2,Ca(OH)2俗名熟石灰,可作为沉淀镁离子的试剂和镁离子反应生成Mg(OH)2;氢氧化镁和盐酸反应得到氯化镁和水,反应的离子方程式为Mg(OH)2+2H+==Mg2++2H2O,故答案为:熟石灰;Mg(OH)2+2H+==Mg2++2H2O;
(4)①灼烧固体时所用的主要仪器名称是坩埚;步骤②加热煮沸一会的目的是促使海带灰中含碘物质快速充分溶解;
②加入氢离子和过氧化氢起的作用为氧化剂,将碘离子转化为单质碘,离子方程式为 2I-+H2O2+2H+==I2+2H2O;碘的CCl4溶液呈紫或紫红色;从碘的提取CCl4提取碘可以用反萃取的方法,故答案为:2I- + H2O2 + 2H+ = I2 + 2 H2O;紫或紫红;反萃取。


科目:高中化学 来源: 题型:
【题目】反应NH4HS(s)![]() NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
A. 温度、容积不变时,通入SO2气体 B. 移走一部分NH4HS固体
C. 将容器体积缩小为原来的一半 D. 保持压强不变,充入氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
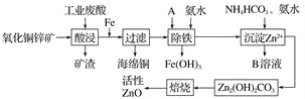
【题目】某科研小组设计出利用工业废酸(稀硫酸)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示。
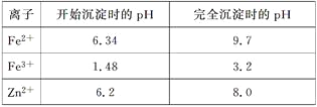
已知:各离子开始沉淀及完全沉淀时的pH如表所示:
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是(任写一点即可)__________________________________________________________。
(2)物质A最好使用下列物质中的____________(填选项序号)。
A.KMnO4 B.H2O2 C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在__________范围之间。
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的氢氧化铁可用次氯酸钾溶液在碱性环境将其氧化得到一种高效的多功能处理剂(K2FeO4),写出该反应的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构为 , 下列有关说法正确的是
, 下列有关说法正确的是
A. 1 mol A能跟2 mol NaOH溶液反应
B. 能发生加聚反应
C. 不能发生分子内酯化反应
D. A分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是
A.该元素原子处于能量最低状态时,原子中共有3个未成对电子
B.该元素原子核外共有4个能层
C.该元素原子的M能层共有8个电子
D.该元素原子最外层共有3个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH的关系图如下所示,下列说法正确的是

A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+1/2c(HA2-)+1/3c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,c(HA2-)/c(H3A)=100.6
D. 向H3A溶液中加入氨水使pH从5→9发生的主要离子反应是:H2A-+OH-![]() HA2-+H2O
HA2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选做-选修5: 有机化学基础】PET和PMMA是日常生活常见的两种高分子材料。下列是合成高分子材料的路线:
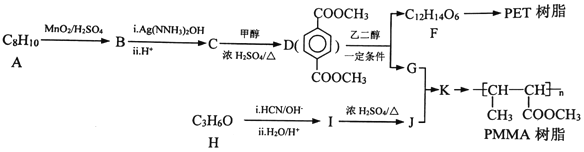
已知:①RCOOR1+R2OH![]() RCOOR2+R1OH
RCOOR2+R1OH
②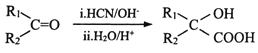 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)
回答下列问题:
(1)物质A的化学名称_______,物质H中官能团的名称________。
(2)由C生成D、I生成J的反应类型分别是_______、_______。
(3)由I生成J的反应中产生六元环的副产物,其结构简式为_______。
(4)写出D+乙二醇→F+G的化学反应方程式________________。
(5)D存在多种同分异构体,其中只含有一种官能团的三取代芳香族化合物且能与碳酸氢钠溶液作用产生气体的同分异构体有____种。
(6)写出用环己醇为原料制备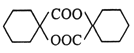 的合成路线(其他试剂任选)_________。
的合成路线(其他试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验能达到实验目的的是
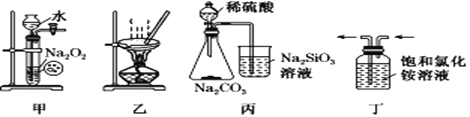
A. 利用甲装置制备少量O2 B. 利用乙装置制备无水氯化镁
C. 利用丙装置比较元素非金属性强弱 D. 利用丁装置收集氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com