
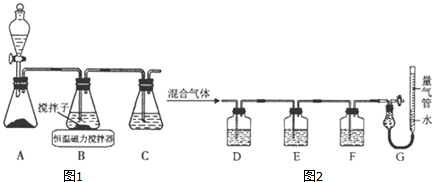
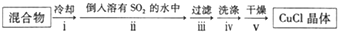
分析 (1)①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气;
②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以与溶液中氧气反应;CuCl难溶于水、稀盐酸和乙醇;
③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封;
④利用浓盐酸溶解CuCl生成H3CuCl4,过滤分离,再用水稀释后过滤分离;
(2)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水.
解答 解:(1)①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气,
故答案为:吸收未反应的二氧化硫;
②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以防止CuCl被氧化;CuCl难溶于水、稀盐酸和乙醇,可以用水、稀盐酸或乙醇洗涤,减小因溶解导致的损失,
故答案为:促进CuCl析出、防止CuCl被氧化;水、稀盐酸或乙醇;
③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存,
故答案为:避光、密封保存;
④提纯某混有铜粉的CuCl晶体实验方案:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl,
故答案为:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl;
(2)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积,
故答案为:氢氧化钡溶液;CuCl的盐酸溶液;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O,
故答案为:2S2O42-+3O2+4OH-=4SO42-+2H2O.
点评 本题考查物质制备实验、物质含量测定实验,属于拼合型题目,侧重考查学生对信息获取与迁移运用,关键是对原理的理解,需要学生具备扎实的基础.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:填空题
 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
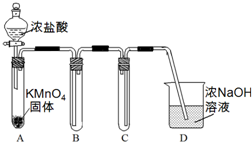 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | 6mL | 3mL | 0mL |
| 硫酸(6mol/L) | 0mL | 2mL | (5)mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, 生成黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
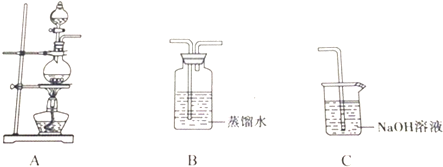
| 实验 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应至少产生了一种酸性强于碳酸的物质 |
| Ⅱ | 向品红溶液中滴入氯水 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
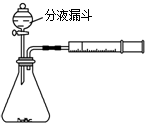 学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:
学习了“化学反应的速率是通过实验测得的”以后,某同学设计了下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y原子M电子层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的+1价阳离子的核外有3层电子且各层均处于全满状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子的还原性:Y2-<Z- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 粒子半径:cY2->dZ->bX+>aW3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com