
【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
【答案】C
【解析】
A.依据铝能与热水反应,实验Ⅰ中没有气泡冒出,说明表面有氧化膜,实验Ⅲ有气泡冒出,说明氧化膜被破坏,故A正确;
B.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主,水解离子方程式:CO32-+H2O![]() HCO3-+OH-,故B正确;
HCO3-+OH-,故B正确;
C.盐类水解为吸热过程,加热促进盐类水解,氢气逸出有利于铝与氢氧根离子的反应,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,消耗氢氧根离子,促进碳酸根离子水解,所以加热和H2逸出对CO32-水解平衡移动都起到促进作用,故C错误;
D.碳酸钠水解显碱性,铝表面的氧化铝与碱反应生成偏铝酸根离子,去掉氧化膜后,铝与氢氧根离子、水反应生成氢气,碳酸根离子部分水解生成碳酸氢根离子,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和二氧化碳,离子方程式:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,故D正确;
故答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下常压下,1g固态碳与水蒸气恰好完全反应,反应生成气体CO和H2,吸收10.94kJ热量,此反应的热化学方程式为___。
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-Q1kJ·mol-1,
②2H2(g)+O2(g)=2H2O(g) ΔH2=-Q2kJ·mol-1,
③2H2(g)+O2(g)=2H2O(l) ΔH3=-Q3kJ·mol-1。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___kJ。
(3)以H2为燃料可制成氢氧燃料电池。已知:2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。下列说法正确的是( )
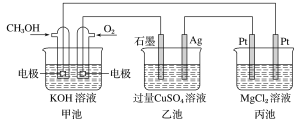
A. 1min内甲池消耗1mol O2转移的电子是乙池Ag电极转移电子数的4倍
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 其一种单质可吸收紫外线,是地球的保护伞 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1)B元素符号为___,G的元素名称为___,它的一种同位素可测定文物年代,这种同位素的符号是___。
(2)A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为___(填“离子化合物”或“共价化合物”),包含的化学键有__(填“离子键”、“极性共价键”或“非极性共价键”)。
(3)F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为__和__,并用电子式表示出其最简单气态氢化物的形成过程___。
(4)D在元素周期表中的位置__,D与E相比非金属性较强的是__(填元素名称),请从原子结构的角度解释原因:__。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。
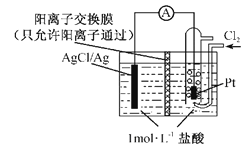
①正极反应为_________。
②当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少______mol离子。
(2)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
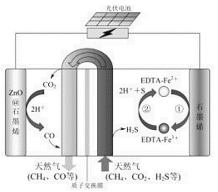
该装置工作时,阴极的电极反应:_________;协同转化总反应:___________;若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为_______性(碱性、中性、酸性)
(3)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池正极极增重______g。
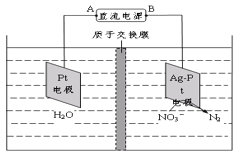
(4)电化学降解法可用于处理酸性硝酸盐污水,设计一电解池(如图所示)。 若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A分子式为C9H10O2,B的相对分子质量比A大79,J是乙酸,K是聚乙酸乙烯酯的单体,G与氯化铁溶液能发生显色反应,且苯环上的一元取代物只有两种。A→K之间有如下转化关系:
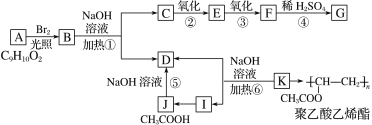
已知:①当羟基与双键碳原子相连时,易发生转化:RCH==CHOH→RCH2CHO
②—ONa连在烃基上不会被氧化。
请回答下列问题:
(1)化合物K的结构简式是_______。I中官能团的名称为______。
(2)反应①④⑤⑥中属于水解反应的是___(填反应编号)。由C→G操作顺序为②③④,而不采取④②③,原因是______。
(3)G可以与NaHCO3溶液反应,1 molG与NaHCO3溶液反应时最多消耗____molNaHCO3。
(4)写出B→C+D的化学方程式_____________。
(5)同时符合下列要求的A的同分异构体有________种(不考虑立体异构)。
Ⅰ.含有苯环;Ⅱ.能发生银镜反应和水解反应。
在这些同分异构体中,满足下列条件的同分异构体的结构简式为________。
①核磁共振氢谱有5个吸收峰;②1mol该同分异构体只能与1molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是
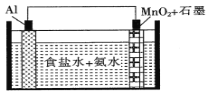
A. 石墨电极上的电势比Al电极上的低
B. Al电极区的电极反应式:A1-3e-+3NH3·H2O=Al(OH)3+3NH4+
C. 每消耗27gAl,有3mol电子通过溶液转移到石墨电极上
D. 若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb =3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
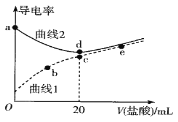
A. 曲线1代表四甲基氢氧化铵溶液
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b点溶液中:c(Cl-)=c(CH3NH3+)+c(CH3NH2·H2O)
D. 常温下,CH3NH3Cl水解常数的数量级为10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
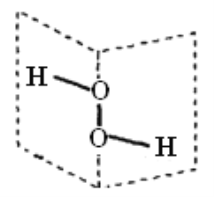
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com